超10款新藥獲批臨床 !來(lái)自博際生物�、齊魯制藥、康方生物等公司
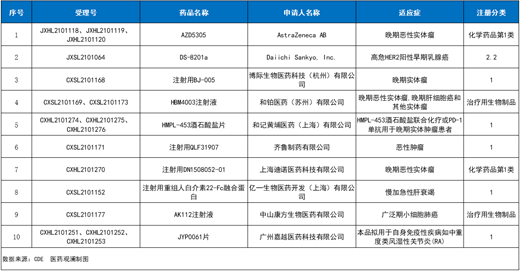
中國(guó)國(guó)家藥監(jiān)局藥品審評(píng)中心(CDE)新公示��,有多款新藥獲得臨床試驗(yàn)?zāi)驹S可���。這些產(chǎn)品中有下一代PARP抑制劑�����、PD-L1/TGF-β雙功能性融合蛋白�����、靶向HER2的抗體偶聯(lián)藥物(ADC)���、FGFR 1/2/3抑制劑等���,來(lái)自阿斯利康(AstraZeneca)、博際生物����、和黃醫(yī)藥、康方生物����、和鉑醫(yī)藥等公司。本文將分享其中10款新藥的基本信息�,僅供讀者參閱。
1�����、阿斯利康:AZD5305
作用機(jī)制:下一代PARP抑制劑
適應(yīng)癥:晚期惡性實(shí)體瘤
PARP抑制劑是首類利用“合成致死”概念在臨床上取得成功的藥物?����!昂铣芍滤馈笔侵竷蓚€(gè)非致死基因同時(shí)被抑制�,導(dǎo)致細(xì)胞死亡的現(xiàn)象。然而�����,大多數(shù)第一代PARP抑制劑并未針對(duì)整個(gè)PARP家族的選擇性進(jìn)行優(yōu)化����,這可能會(huì)引起不良作用����,比如腸道毒性或血液學(xué)毒性,并且限制了它們與化療聯(lián)合的能力���。近期研究表明�����,這種不良作用可能是由于抑制PARP2所引起���。
AZD5305是一款專門針對(duì)PARP1設(shè)計(jì)的下一代PARP抑制劑����,目前正在全球開(kāi)展針對(duì)晚期實(shí)體瘤的1/2a期���、開(kāi)放標(biāo)簽���、多中心研究。在2021年美國(guó)癌癥研究協(xié)會(huì)(AACR)年會(huì)上�,阿斯利康公布了AZD5305的結(jié)構(gòu)及早期數(shù)據(jù)。臨床前研究顯示�,AZD5305對(duì)PARP1的選擇性高于PARP2和其他PARP酶,這使其有望提高其選擇性���,并且降低毒性�����,同時(shí)還有望增加與其他療法聯(lián)用的潛力���。此次,該產(chǎn)品在中國(guó)獲批臨床��,擬開(kāi)發(fā)用于晚期惡性實(shí)體瘤。
2�����、第一三共/阿斯利康:DS-8201a
作用機(jī)制:靶向HER2的ADC
適應(yīng)癥:高危HER2陽(yáng)性早期乳腺癌
DS-8201a(trastuzumab deruxtecan)是由第一三共(Daiichi Sankyo)和阿斯利康共同開(kāi)發(fā)的一款靶向HER2的抗體偶聯(lián)藥物���。它利用了第一三共特有的ADC技術(shù)��,將人源HER2抗體曲妥珠單抗通過(guò)四肽接頭與一種新型拓?fù)洚悩?gòu)酶1抑制劑鏈接����,靶向癌細(xì)胞����,并將藥物遞送至細(xì)胞內(nèi)部��。此次�,該產(chǎn)品在中國(guó)獲批臨床,擬開(kāi)發(fā)用于高危HER2陽(yáng)性早期乳腺癌���。
值得一提的是����,此前DS-8201a曾被CDE納入突破性治療品種,擬單藥用于既往接受過(guò)一種或一種以上治療方案的HER2陽(yáng)性局部晚期或轉(zhuǎn)移性胃或食管胃結(jié)合部腺癌成人患者的治療��。在海外�����,DS-8201a已在美國(guó)����、日本等地獲批用于治療不可切除或轉(zhuǎn)移性HER2陽(yáng)性乳腺癌成人患者,及局部晚期或轉(zhuǎn)移性HER2陽(yáng)性胃或胃食管交界處腺癌成人患者��。
3�、博際生物:注射用BJ-005
作用機(jī)制:PD-L1/TGF-β雙功能性融合蛋白
適應(yīng)癥:晚期實(shí)體瘤
由于雙功能性抗體能夠同時(shí)與兩種抗原相結(jié)合,對(duì)兩種和治療癌癥相關(guān)的信號(hào)通路進(jìn)行調(diào)節(jié)�����,這類療法在近年來(lái)受行業(yè)廣泛關(guān)注�����。其中����,PD-L1與TGF-β就是一個(gè)備受歡迎的組合�。眾所周知���,PD-1/PD-L1信號(hào)通路在腫瘤免疫的逃逸中扮演著重要角色�。TGF-β則是一種多功能的多肽類細(xì)胞因子���,在腫瘤的抑制和腫瘤進(jìn)展中發(fā)揮作用��。
BJ-005是一種重組雙功能融合蛋白���,由PD-L1靶向IgG1單克隆抗體與TGF-β受體II胞外域的一部分融合而成。該產(chǎn)品可同時(shí)靶向PD-L1和TGF-β����,通過(guò)靶向免疫檢查點(diǎn)和調(diào)節(jié)腫瘤細(xì)胞生長(zhǎng)的細(xì)胞因子途徑�����,從而抑制腫瘤生長(zhǎng)����,達(dá)到癌癥治療的目的。2021年6月��,BJ-005已在美國(guó)獲批臨床,成為博際生物第2款獲FDA臨床許可的自主研發(fā)產(chǎn)品�。此次,該產(chǎn)品在中國(guó)獲批臨床���,擬開(kāi)發(fā)用于晚期實(shí)體瘤����。
4�����、和鉑醫(yī)藥:HBM4003注射液
作用機(jī)制:新一代抗CTLA-4全人源重鏈抗體
適應(yīng)癥:晚期惡性實(shí)體瘤�����、晚期肝細(xì)胞癌和其他實(shí)體瘤
HBM4003是新一代抗CTLA-4全人源重鏈抗體�����,可通過(guò)顯著增強(qiáng)抗體依賴性細(xì)胞介導(dǎo)的細(xì)胞毒作用(ADCC)�,特異性地清除腫瘤微環(huán)境中高表達(dá)CTLA-4的Treg細(xì)胞。臨床前研究表明���,該產(chǎn)品具有更強(qiáng)的抗腫瘤活性��、差異化的藥代動(dòng)力學(xué)和藥效動(dòng)力學(xué)特征�。此次HBM4003在中國(guó)獲得兩項(xiàng)臨床試驗(yàn)?zāi)驹S可,擬開(kāi)發(fā)適應(yīng)癥包括:晚期惡性實(shí)體瘤�、晚期肝細(xì)胞癌和其他實(shí)體瘤。
在2021年歐洲腫瘤內(nèi)科學(xué)會(huì)(ESMO)年會(huì)上�,和鉑醫(yī)藥將公布一項(xiàng)HBM4003單藥治療晚期實(shí)體瘤的1期臨床試驗(yàn)結(jié)果。該研究數(shù)據(jù)顯示����,HBM4003表現(xiàn)出了良好的有效性、安全性和耐受性���。研究同時(shí)也顯示��,HBM4003在人體中的免疫原性極低��,并且印證了臨床前研究中發(fā)現(xiàn)的特有的PK/PD特性及全新的作用機(jī)制����。
5�����、和黃醫(yī)藥:HMPL-453酒石酸鹽片
作用機(jī)制:FGFR 1/2/3抑制劑
適應(yīng)癥:聯(lián)合化療或抗PD-1單抗用于晚期實(shí)體腫瘤患者
HMPL-453是一種在研高選擇性小分子FGFR 1/2/3抑制劑�����,通過(guò)靶向目標(biāo)區(qū)域來(lái)阻斷FGFR介導(dǎo)的信號(hào)通路��,從而達(dá)到抑制腫瘤生長(zhǎng)的目的���。目前��,該產(chǎn)品已在中國(guó)啟動(dòng)了晚期惡性間皮瘤的2期臨床試驗(yàn)��,以及針對(duì)晚期肝內(nèi)膽管癌患者的2期研究�。此次HMPL-453在中國(guó)獲批臨床�,擬開(kāi)發(fā)適應(yīng)癥為:聯(lián)合化療或抗PD-1單抗用于晚期實(shí)體腫瘤患者。
根據(jù)和黃醫(yī)藥公布的2021年中期業(yè)績(jī)及業(yè)務(wù)進(jìn)展�����,HMPL-453有望于2021年底或2022年初在中國(guó)啟動(dòng)與其他抗癌療法的聯(lián)合療法的研究����。
6、齊魯制藥:注射用QLF31907
作用機(jī)制:PD-L1/4-1BB雙特異性抗體
適應(yīng)癥:惡性腫瘤
根據(jù)齊魯制藥早前新聞稿�����,QLF31907是其研發(fā)的一款雙特異性抗體,可同時(shí)靶向PD-L1和4-1BB(CD137)�����。一方面�,該產(chǎn)品可以通過(guò)結(jié)合PD-L1來(lái)阻斷PD1/PD-L1免疫抑制通路。另一方面����,它又能激活4-1BB下游免疫活化信號(hào),促進(jìn)免疫細(xì)胞對(duì)腫瘤細(xì)胞的殺傷���。這種雙靶向機(jī)制有望極大增強(qiáng)候選藥的抗腫瘤療效���。
臨床前試驗(yàn)中,QLF31907在安全性及有效性方面表現(xiàn)較好�����,相比抗PD-L1單抗有明顯的有效性����。此次該產(chǎn)品獲批臨床,擬開(kāi)發(fā)用于惡性腫瘤���。
7���、迪諾醫(yī)藥:注射用DN1508052-01
作用機(jī)制:TLR8激動(dòng)劑
適應(yīng)癥:晚期惡性實(shí)體瘤
DN1508052-01是一款高效的小分子Toll樣受體8(TLR8)激動(dòng)劑,用于癌癥免疫治療��。TLR受體是先天免疫系統(tǒng)中重要的一部分����,激活這些受體能夠在腫瘤微環(huán)境中改善樹(shù)突狀細(xì)胞和巨噬細(xì)胞的抗原呈現(xiàn),并且促進(jìn)CD8+ T細(xì)胞的增殖�����。在TLRs家族中共有13種TLR����,其中TLR8與自身免疫性疾病密切相關(guān),主要表達(dá)于單核細(xì)胞�、巨噬細(xì)胞、及髓系樹(shù)突狀細(xì)胞��,應(yīng)用前景十分廣闊�,是腫瘤免疫治療領(lǐng)域的新星。
此前,DN1508052-01已先后在美國(guó)和中國(guó)獲批臨床�����。其中����,該產(chǎn)品已在中國(guó)獲批開(kāi)展臨床研究的適應(yīng)癥為:用于治療在標(biāo)準(zhǔn)治療后疾病進(jìn)展或無(wú)標(biāo)準(zhǔn)治療的晚期實(shí)體腫瘤。此次DN1508052-01再次獲批臨床���,擬開(kāi)發(fā)用于晚期惡性實(shí)體瘤����。根據(jù)ClinicalTrials網(wǎng)站�,目前迪諾醫(yī)藥已啟動(dòng)了一項(xiàng)開(kāi)放、多中心的1期臨床試驗(yàn)��,以初步評(píng)估該產(chǎn)品單藥經(jīng)皮下注射用于實(shí)體瘤患者的安全耐受��、藥物代謝動(dòng)力學(xué)特性及抗腫瘤活性��。
8�����、億一生物:F-652
作用機(jī)制:注射用重組人白介素22-Fc融合蛋白
適應(yīng)癥:慢加急性肝衰竭
根據(jù)億帆醫(yī)藥公告,F(xiàn)-652是其子公司億一生物擁有自主知識(shí)產(chǎn)權(quán)的1類創(chuàng)新生物藥�,為利用基因工程技術(shù)通過(guò)CHO細(xì)胞表達(dá)的重組人白細(xì)胞介素22-Fc(IgG2)融合蛋白。據(jù)公告介紹�,該產(chǎn)品完全模擬人體白介素22的活性機(jī)理�,F(xiàn)c片段大大延長(zhǎng)了白介素22的半衰期,在藥物療效方面具有顯著提升�。
截至目前,F(xiàn)-652已在全球范圍內(nèi)完成了5項(xiàng)臨床研究���。其中�,包括在美國(guó)開(kāi)展的兩項(xiàng)2a 期臨床試驗(yàn)�����,分別針對(duì)急性移植物抗宿主?�。℅vHD)和急性酒精性肝炎(AH)��。這些試驗(yàn)均達(dá)到預(yù)設(shè)目標(biāo)����,表明候選藥具有良好的安全性和有效性。F-652還曾獲得FDA授予治療GvHD的孤兒藥資格�����。此次F-652獲批開(kāi)展的臨床研究為一項(xiàng)F-652聯(lián)合常規(guī)方案治療慢加急性肝衰竭的2期臨床試驗(yàn)。
9�����、康方生物:AK112注射液
作用機(jī)制:PD-1/VEGF雙特異性抗體
適應(yīng)癥:廣泛期小細(xì)胞肺癌
AK112是康方生物研發(fā)的新型腫瘤免疫治療藥物��,它是一款PD-1/VEGF雙特異性抗體����。該產(chǎn)品既可以阻斷PD-1與PD-L1和PD-L2的結(jié)合,又可以阻斷VEGF與VEGF受體的結(jié)合�����,因而同時(shí)具有免疫治療藥物和抗血管生成藥物的療效特性���。早期研究表明�����,AK112同時(shí)阻斷這兩個(gè)靶點(diǎn)����,與聯(lián)合療法相比可能會(huì)更有效地阻斷這兩個(gè)通路,從而增強(qiáng)抗腫瘤活性��。
此前��,AK112已在中國(guó)����、澳大利亞等國(guó)家開(kāi)展了劑量爬坡和擴(kuò)展的1期臨床研究�。2021年5月,康方生物又分別開(kāi)展多項(xiàng)單藥或聯(lián)合用藥的臨床試驗(yàn)��,適應(yīng)癥涵蓋非小細(xì)胞肺癌�����、復(fù)發(fā)性卵巢癌����、婦科腫瘤等。此次該產(chǎn)品再次獲批臨床���,擬開(kāi)發(fā)用于廣泛期小細(xì)胞肺癌�。
10���、嘉越醫(yī)藥:JYP0061片
適應(yīng)癥:自身免疫性疾病
根據(jù)CDE官網(wǎng)公示��,JYP0061是嘉越醫(yī)藥在研的一款1類小分子新藥���,此次為該產(chǎn)品首次在中國(guó)獲批臨床��,擬開(kāi)發(fā)用于中重度類風(fēng)濕性關(guān)節(jié)炎等自身免疫性疾病���。嘉越醫(yī)藥致力于創(chuàng)新藥研發(fā),重點(diǎn)開(kāi)發(fā)腫瘤和自身免疫�、代謝類和感染性等疾病領(lǐng)域。目前該公司已建立多樣化的研發(fā)管線�����,有十多個(gè)臨床試驗(yàn)同步推進(jìn)中���。
聲明:本文版權(quán)歸原作者所有�����,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán),請(qǐng)聯(lián)系我們���,我們將在及時(shí)修改或刪除內(nèi)容��,聯(lián)系郵箱:marketing@360worldcare.com