盤點2019年美國批準乳腺癌的“新藥方”
乳腺癌是女性一大癌癥。根據(jù)國家癌癥中心發(fā)布的2017年《中國腫瘤登記年報》顯示�,我國每年新發(fā)乳腺癌病例約27.9萬,乳腺癌居女性惡性腫瘤發(fā)病率較高�����。

雖然乳腺癌在女性惡性腫瘤中發(fā)病率較高��,但相比于其他惡性腫瘤�����,乳腺癌并沒有想象中那么可怕���。目前國內(nèi)乳腺癌總體的5年生存率可達80%��,發(fā)達國家更高��,比如美國乳腺癌5年生存率已超過90%��。這主要歸因于乳腺癌的早期篩查和治療方案的不斷推陳出新����。
以HER2陽性乳腺癌的治療為例,過去一年���,美國FDA在該領(lǐng)域又通過了3個重要審批:
2019年2月28日�,F(xiàn)DA批準皮下注射劑Herceptin Hylecta上市����。Herceptin Hylecta是曲妥珠單抗(Trastuzumab)和重組人透明質(zhì)酸酶(hyaluronidase)組成的復(fù)方藥物,獲批用于治療成人HER2過表達的轉(zhuǎn)移性乳腺癌�。
HER2的表達主要是通過免疫組化CerbB2的表達來判斷,如果免疫組化結(jié)果為3+�,或者未達到3+水平但在FISH或CISH中證實是有HER2基因擴增的,均可考慮為HER2陽性型乳腺癌��。
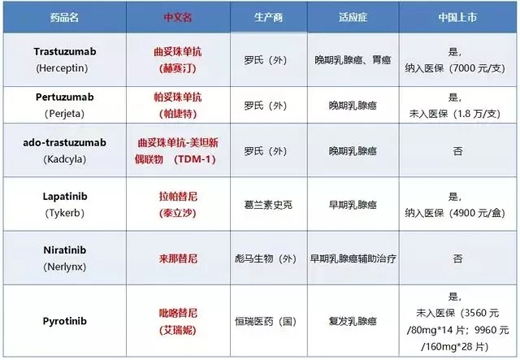
HER2陽性乳腺癌患者約占所有乳腺癌的20%���,既往已獲批的藥物也不少(如下圖示)����。

Herceptin Hylecta的獲批,為患者和臨床醫(yī)生提供了一種新的選擇�����,可以根據(jù)個人需求和偏好選擇治療方案�����。
2019年5月3日�����,F(xiàn)DA批準抗體偶聯(lián)藥物Kadcyla(Trastuzumab Emtansine)用于HER2陽性早期乳腺癌患者的輔助(術(shù)后)治療����,這些患者此前接受基于紫杉烷和赫賽?���。ㄇ字閱慰梗┬螺o助(術(shù)前)治療后仍存在殘存病灶。
研究結(jié)果顯示����,HER2陽性早期乳腺癌新輔助治療完成后有殘存病灶的患者,輔助治療使用Kadcyla相比赫賽汀,可使乳腺癌復(fù)發(fā)風(fēng)險降低50%����。
2019年12月20日,F(xiàn)DA加快批準靶向HER2的抗體偶聯(lián)藥物(ADC)ENHERTU(famr -trastuzumab deruxtecan-nxki)用于治療無法切除或轉(zhuǎn)移性HER2陽性乳腺癌患者�����,這些患者在癌癥發(fā)生轉(zhuǎn)移的情況下已接受過兩種或兩種以上基于抗HER2的方案��。
試驗結(jié)果表明����,所有接受ENHERTU治療的患者的客觀反應(yīng)率(ORR)達60.3%,完全應(yīng)答率(CR)為4.3%�����,中位持續(xù)反應(yīng)時間(DOR)為14.8個月��。該藥的獲批有助于滿足晚期患者的治療需求�����。
此外�����,2019年在三陰性乳腺癌和ER+/PR+/HER2-乳腺癌的治療上,F(xiàn)DA也取得了新的審批進展���。
2019年3月8日��,F(xiàn)DA基于Ⅲ期臨床的PFS數(shù)據(jù)加速批準了阿替利珠單抗(atezolizumab)與化療(蛋白結(jié)合型紫杉醇)聯(lián)用治療局部晚期或轉(zhuǎn)移性三陰性乳腺癌(要求腫瘤浸潤免疫細胞PD-L1≥1%)�。作為全球一個批準的PD-L1抑制劑�����,阿替利珠單抗此前已獲批一線治療尿路上皮癌和非小細胞肺癌�。
2019年5月24日����,F(xiàn)DA批準Alpelisib(Piqray)片劑與FDA批準的內(nèi)分泌治療藥物氟維司群聯(lián)用,治療患有晚期或轉(zhuǎn)移性乳腺癌的絕經(jīng)后女性和男性����,這些患者通過FDA批準的試驗檢測為激素受體(HR)陽性,人表皮生長因子受體2(HER2)陰性��,PIK3CA突變�,接受內(nèi)分泌治療方案之中或之后疾病進展。

目前,乳腺癌是用藥選擇多的癌癥種類之一�����。即使發(fā)現(xiàn)癌癥處于晚期��,不斷涌現(xiàn)的新療法也可以幫助患者延長生存期����,保持良好的生活質(zhì)量。只要你不放棄治療機會��,就一定有希望���。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤����,或侵犯您的版權(quán),請聯(lián)系我們�����,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com





