通過基因工程技術(shù)將T細(xì)胞激活�,并裝上定位導(dǎo)航到腫瘤的裝置-腫瘤嵌合抗原受體(Chimeric Antigen Receptor, CAR)�,可以將T細(xì)胞這個普通“武器”改造成“超級武器”���,即為CAR-T細(xì)胞。CAR-T是治療B細(xì)胞惡性腫瘤的有效療法�,但在實體瘤中療效有限。這些限制性的因素包括:腫瘤部位T細(xì)胞的遷移和浸潤不足���、抑制信號的持續(xù)存在�、腫瘤限制性抗原的缺乏�����。此外�,CAR-T療法的治療潛力也取決于CAR-T與腫瘤細(xì)胞之間形成裂解免疫突觸(lytic immune synapse, IS)的形成。
糖基化是常見的蛋白質(zhì)修飾之一��,產(chǎn)物以糖蛋白的形式出現(xiàn)��。糖蛋白是聚糖與蛋白質(zhì)的天冬酰胺或絲氨酸�����、蘇氨酸殘基共價連接而成�����。與正常細(xì)胞相比���,腫瘤細(xì)胞往往表現(xiàn)出異常的糖基化����,形成一種極其多樣的細(xì)胞外聚糖外衣�����。這種聚糖外衣可能通過屏蔽免疫細(xì)胞的抗原表位或干擾免疫細(xì)胞功能�,對抗腫瘤反應(yīng)產(chǎn)生不利影響。b1–6 N-聚糖分支增多是腫瘤細(xì)胞頻繁的變異之一��,該糖基化修飾是N-乙酰氨基葡萄糖轉(zhuǎn)移酶V(由MGAT5基因編碼)活性增加的結(jié)果����。MGAT5的表達(dá)受Ras-Raf-Ets信號通路的正向調(diào)控,該通路在腫瘤中通常異常激活����,并直接參與腫瘤的生長、侵襲和轉(zhuǎn)移����,在多種腫瘤模型中均被證明與生存降低和預(yù)后不良相關(guān)�。
2022年1月19日�����,來自意大利的研究人員發(fā)現(xiàn)多種腫瘤的細(xì)胞外N-聚糖表達(dá)豐度與CAR-T細(xì)胞殺傷程度呈負(fù)相關(guān)�。他們通過敲除胰腺癌(PAC)中的MGAT5發(fā)現(xiàn),N-聚糖能干擾免疫突觸形成�,減少轉(zhuǎn)錄激活、細(xì)胞因子和細(xì)胞毒性�,保護(hù)腫瘤免受CAR-T細(xì)胞的殺傷。這意味著�����,一旦破壞腫瘤細(xì)胞上的N-聚糖這層“糖衣”�,CAR-T細(xì)胞活性即得到增強(qiáng),成為殺傷胰腺癌的重磅“炮彈”��。研究成果在線發(fā)表于新一期的Science Translational Medicine(STM)�����。
研究成果(圖源:STM)
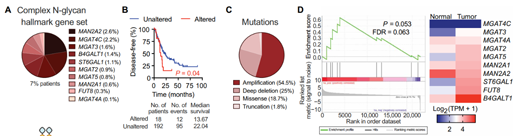
為了揭示N-聚糖在胰腺癌中的生物學(xué)作用����,研究人員首先利用生物信息學(xué)數(shù)據(jù)庫分析了參與這些糖基合成的糖基轉(zhuǎn)移酶的突變情況,發(fā)現(xiàn)cBioportal的3738名患者中���,有19%樣本攜帶參與N-聚糖合成的糖基轉(zhuǎn)移酶的基因組改變�����,且這一特征與不良預(yù)后相關(guān)�。進(jìn)一步分析確定僅分支型N-聚糖合成的基因變異與惡化的無病生存顯著相關(guān)��,且大多數(shù)變異都是基因擴(kuò)增����。結(jié)合TCGA數(shù)據(jù)庫中胰腺癌樣本的RNA測序數(shù)據(jù)的富集分析顯示,與健康對照組相比��,患者中分支型N-聚糖合成通路顯著富集����。在富集的基因中,研究者重點關(guān)注了分支型N-聚糖生物合成的關(guān)鍵基因MGAT5��。
胰腺癌患者的N-聚糖合成相關(guān)的基因變異及預(yù)后(圖源:STM)
敲除MGAT5后發(fā)現(xiàn)���,CAR-T細(xì)胞44v6.28?的抗腫瘤效果顯著增強(qiáng)����,表現(xiàn)為腫瘤細(xì)胞溶解活性增加,干擾素和腫瘤壞死因子水平上升���。這些結(jié)果說明���,分支型N-聚糖屏蔽了CAR-T對胰腺癌抗原44v6.28?的靶向性。
敲除MGAT5后腫瘤細(xì)胞與CAR-T細(xì)胞的變化(圖源:STM)
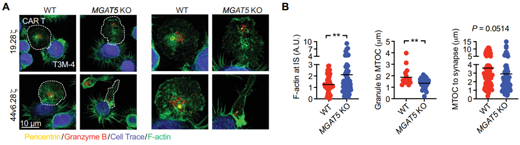
為了探明N-聚糖缺陷腫瘤細(xì)胞使得抗腫瘤療效增強(qiáng)的基礎(chǔ)��,研究者分析了CAR-T細(xì)胞靶向過程的限制性步驟——免疫突觸IS的形成�。結(jié)果顯示,缺乏MGAT5聚糖產(chǎn)物的胰腺癌細(xì)胞與CAR-T44v6.28?之間形成了良好的IS��,具有更高的F -肌動蛋白積累����,更強(qiáng)的顆粒聚合,以及MTOC到F-肌動蛋白的距離縮短����,這些是功能性細(xì)胞溶解的三個公認(rèn)參數(shù)。對照組細(xì)胞中則沒有觀察到這種差異���。該團(tuán)隊還結(jié)合Jurkat細(xì)胞模型來分析細(xì)胞內(nèi)信號轉(zhuǎn)導(dǎo)事件�,也得到與上述一致的結(jié)論���。這些發(fā)現(xiàn)支持了胰腺癌對CAR-T細(xì)胞治療的抵抗機(jī)制�,即腫瘤接觸和CAR-T信號強(qiáng)度受分支型N-聚糖的調(diào)控����。
敲除MGAT5后免疫突觸與功能性細(xì)胞溶解情況(圖源:STM)
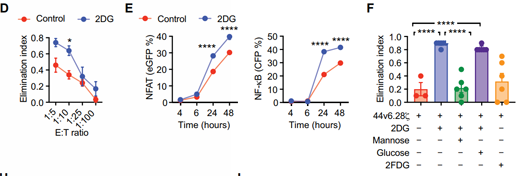
既然基因?qū)用鎸-聚糖的抑制顯示出了良好效果,那么從藥理學(xué)上克服腫瘤糖基化是否也能取得類似效果�����?研究者巧妙地利用葡萄糖/甘露糖類似物2DG來實現(xiàn)這一干預(yù)����。2DG此前已被報道能干擾N -鏈糖基化,合并成新生糖蛋白的脂聯(lián)寡糖�����,引起糖基化整體異常狀態(tài)�����。研究人員發(fā)現(xiàn),經(jīng)2DG處理的胰腺癌細(xì)胞能被44v6.28細(xì)胞更有效地殺死�,并在44v6.28細(xì)胞中引發(fā)了更強(qiáng)的轉(zhuǎn)錄作用,但在對照細(xì)胞中卻沒有這種效應(yīng)���。在胰腺癌小鼠異種移植模型中的實驗數(shù)據(jù)顯示�,無論是低腫瘤負(fù)荷��、高CAR-T細(xì)胞劑量模型�����,還是高腫瘤負(fù)荷��、低CAR-T細(xì)胞劑量模型�����,2DG預(yù)先注射都能使得腫瘤對CAR-T細(xì)胞的攻擊更加敏感��。此外����,該研究還觀察到細(xì)胞表達(dá)抑制性受體的頻率顯著降低,如T細(xì)胞免疫球蛋白域和粘蛋白域3 (TIM-3)���、淋巴細(xì)胞活化3�����、程序性細(xì)胞死亡蛋白1 (PD-1)和CD57���。其中,PD-L1的PD-1相互作用在N-聚糖去除后減弱較為顯著���。這些發(fā)現(xiàn)表明��,與2DG聯(lián)合使用不僅可以提高腫瘤清除能力�����,還可能使CAR-T細(xì)胞避免發(fā)生免疫檢查點的抑制���。
2DG處理后胰腺癌對44v6.28細(xì)胞敏感度的影響(圖源:STM)
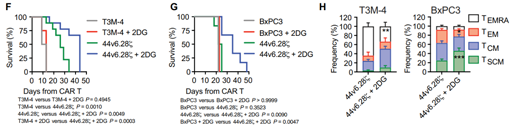
在高腫瘤負(fù)荷胰腺癌異種移植小鼠模型中,研究人員比較2DG和44v6.28細(xì)胞單獨(dú)以及組合的長期聯(lián)合治療�����。在T3M-4異種移植模型中�����,重復(fù)注射2DG單獨(dú)治療小鼠被證明是無益的,而2DG和44v6.28細(xì)胞組合提供了持久的腫瘤控制�����,優(yōu)于兩種單獨(dú)治療方案�����。這一結(jié)果在BxPC3異種移植模型中亦得到證實��。以上結(jié)果均表明��,與2DG聯(lián)合治療可以提高44v6.28?細(xì)胞的效力并減輕T細(xì)胞衰竭�。不僅在胰腺癌,研究人員還發(fā)現(xiàn)與2DG共同治療可提高CAR-T細(xì)胞對包括膀胱癌和卵巢癌在內(nèi)的多種腫瘤的治療效果���。
胰腺癌模型中2DG處理�����、44v6.28細(xì)胞治療的比較(圖源:STM)
總之��,CAR-T細(xì)胞與2DG聯(lián)合治療胰腺癌展現(xiàn)出良好的潛力�,并且在其他多種腫瘤的治療中也取得良好效果,包括來自肺����、卵巢和膀胱的腫瘤?����?偟膩碚f�����,這項研究發(fā)現(xiàn)細(xì)胞外N-聚糖通過增加CAR-T細(xì)胞激活閾值和促進(jìn)CAR-T細(xì)胞衰竭使得腫瘤發(fā)生治療抵抗����,也為合理改進(jìn)實體腫瘤治療方法提供了新的思路和方向��。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息�,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán)��,請聯(lián)系我們�,我們將在及時修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com