阿斯利康/第一三共重磅ADC國內申報上市
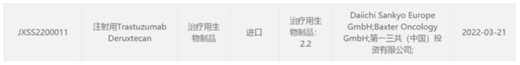
3月21日���,CDE官網顯示���,阿斯利康/第一三共靶向HER2抗體藥物偶聯物(ADC) Enhertu (trastuzumab deruxtecan)在國內申報上市���,適應癥未知。
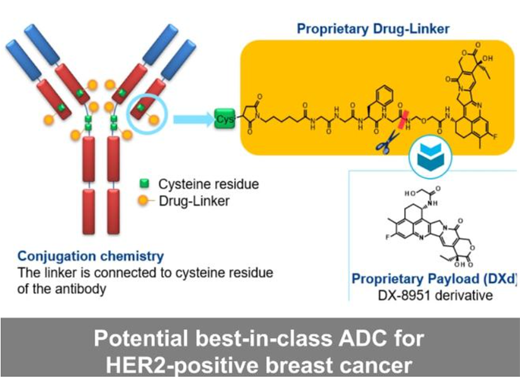
Enhertu是一款靶向HER2的ADC�����,采用第一三共專有的DXd ADC技術設計�����。由HER2單抗通過穩(wěn)定的四肽可裂解連接子連接于拓撲異構酶I抑制劑有效載荷(依沙替康衍生物)上 ��。該產品是第一三共腫瘤產品組合中前列ADC��,也是阿斯利康ADC科學平臺中先進的項目����。
Enhertu早 于2019年12月基于II期DESTINY-Breast01臨床研究結果獲美國FDA批準上市,用于治療既往已經接受2種及以上HER2靶向療法的成人不可手術切除或轉移性HER2陽性乳腺癌患者��。
2021年1月15日第2項適應癥獲FDA批準�����,用于既往接受過基于曲妥珠單抗治療的局部晚期或轉移性HER2陽性胃或胃食管交界處腺癌患者。
今年1月17日�,FDA還受理了Enhertu 治療既往接受過抗HER2治療方案的不可切除或轉移性HER2陽性乳腺癌成人 患者的補充生物制品許可申請(sBLA),并授予該項申請優(yōu)先審評資格�����。
在中國��,Trastuzumab deruxtecan曾獲CDE突破性療法資格�����,單藥用于既往接受過一種或一種以上治療方案的HER2陽性局部晚期或轉移性胃或食管胃結合部(GEJ)腺癌成人患者的治療��。
聲明:本文版權歸原作者所有���,轉載文章僅為傳播更多信息,如作者信息標記有誤���,或侵犯您的版權�,請聯系我們���,我們將在及時修改或刪除內容�,聯系郵箱:marketing@360worldcare.com