阿斯利康/第一三共Enhertu擬納入優(yōu)先審評,二線治療HER2陽性乳腺癌
4月24日�����,CDE官網(wǎng)顯示��,阿斯利康/第一三共靶向HER2抗體藥物偶聯(lián)物(ADC) Enhertu (trastuzumab deruxtecan)被擬納入優(yōu)先審評��,單藥適用于治療既往接受過一種或一種以上抗HER2藥物治療的不可切除或轉(zhuǎn)移性HER2陽性成人乳腺癌患者��。3月21日��,該產(chǎn)品在華申報上市����。
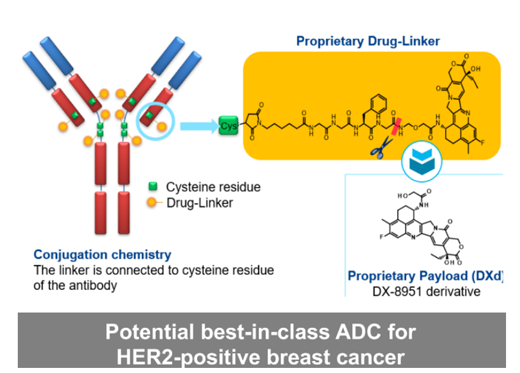
Enhertu是一款靶向HER2的ADC����,采用第一三共專有的DXd ADC技術(shù)設計���。由HER2單抗通過穩(wěn)定的四肽可裂解連接子連接于拓撲異構(gòu)酶I抑制劑有效載荷(依沙替康衍生物)上。該產(chǎn)品是第一三共腫瘤產(chǎn)品組合中前列ADC��,也是阿斯利康ADC科學平臺中先進的項目���。
今年1月17日���,F(xiàn)DA受理了Enhertu治療既往接受過抗HER2治療方案的不可切除或轉(zhuǎn)移性HER2陽性乳腺癌成人患者的補充生物制品許可申請(sBLA),并授予該項申請優(yōu)先審評資格����。
一項代號為DESTINY-Breast03的關鍵III期臨床研究旨在比較Enhertu(5.4mg/kg) vs Kadcyla(恩美曲妥珠單抗,T-DM1)在HER2陽性�、不可切除和/或轉(zhuǎn)移性乳腺癌患者中的療效,這些患者此前曾接受曲妥珠單抗和紫杉烷治療���。
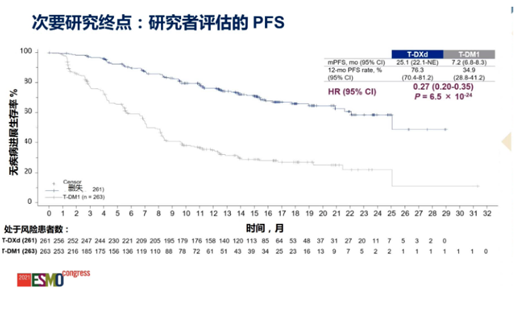
2021年歐洲腫瘤內(nèi)科學會(ESMO)全體大會上公布的中期分析結(jié)果顯示,研究達到了無進展生存期 (PFS) 的主要終點����,與Kadcyla相比,Enhertu將患者的疾病進展或死亡風險降低72%。根據(jù)盲態(tài)獨立中心審評(BICR)評估�����,Enhertu組患者PFS未達到��,Kadcyla組為6.8個月���。在研究者評估的PFS次要終點分析中�����,Enhertu組患者PFS改善25.1個月����,Kadcyla組改善7.2個月��。
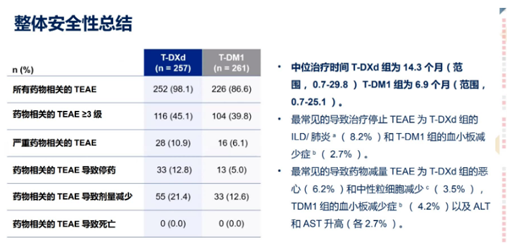
此外����,與Kadcyla相比����,Enhertu在關鍵次要終點總體生存期(OS)方面也顯示出明顯改善趨勢,不過OS數(shù)據(jù)尚未成熟。Enhertu的安全性與之前的臨床試驗一致��,沒有發(fā)現(xiàn)新的安全性問題��,未出現(xiàn)4級或5級治療相關間質(zhì)性肺病事件��。
DESTINY-Breast03是全球眾多HER2 ADC藥物中一個開展與標準療法Kadcyla頭對頭比較的III期研究�,Enhertu該項適應癥一旦批準,將味著HER2陽性乳腺癌的治療策略的重新定義�。乳腺癌仍然是常見的癌癥,并且是全球女性癌癥相關死亡的主要原因之一���。2020年確診乳腺癌患者超過200萬�,導致全球近68.5萬人死亡�。大約五分之一乳腺癌患者為HER2陽性。
聲明:本文版權(quán)歸原作者所有�����,轉(zhuǎn)載文章僅為傳播更多信息�,如作者信息標記有誤,或侵犯您的版權(quán)���,請聯(lián)系我們�����,我們將在及時修改或刪除內(nèi)容�����,聯(lián)系郵箱:marketing@360worldcare.com