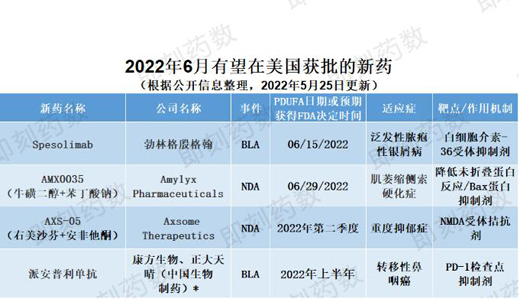
6月份��,預(yù)計(jì)FDA將就以下四種藥物做出是否批準(zhǔn)決定��,詳見下表���。
▲6月有望在美國獲批的新藥(藥明康德內(nèi)容團(tuán)隊(duì)制圖)
藥物名稱:spesolimab
公司名稱:勃林格殷格翰(Boehringer Ingelheim)
適應(yīng)癥:泛發(fā)性膿皰性銀屑?��。℅PP)
勃林格殷格翰的spesolimab是一種人源化選擇性抗體,可阻斷白細(xì)胞介素-36受體(IL-36R)的激活����,正在尋求FDA批準(zhǔn),用于治療泛發(fā)性膿皰性銀屑?。℅PP)的發(fā)作。在為期12周的2期臨床試驗(yàn)中觀察到�����,在治療僅一周后,GPP成年患者的膿皰迅速清除���。FDA于2021年12月接受了生物制品許可申請(qǐng)(BLA)并授予它優(yōu)先審評(píng)資格��,PDUFA日期設(shè)定為6月15日�����。該藥物還在美國獲得孤兒藥資格和突破性療法認(rèn)定�。如果獲得批準(zhǔn)�,spesolimab將成為FDA批準(zhǔn)的一個(gè)治療這種可能危及生命并且存在緊急未滿足需求的罕見皮膚病的藥物。
藥物名稱:AMX0035(?;嵌?苯丁酸鈉)
公司名稱:Amylyx Pharmaceuticals
適應(yīng)癥:肌萎縮側(cè)索硬化癥(ALS)
Amylyx公司的AMX0035是一種專有的口服固定劑量組合,用于治療肌萎縮側(cè)索硬化癥(ALS)�。AMX0035是兩種藥物苯丁酸鈉(sodium phenylbutrate)和牛磺酸二醇(taurursodiol)的復(fù)方制劑�����。苯丁酸鈉是一種小分子蛋白伴侶�,可降低未折疊蛋白反應(yīng)(UPC),防止UPC導(dǎo)致的細(xì)胞死亡�����。牛磺酸二醇是一款Bax蛋白抑制劑��。它們可以改善細(xì)胞內(nèi)線粒體和內(nèi)質(zhì)網(wǎng)的健康狀態(tài)����,從而延緩神經(jīng)細(xì)胞的死亡。向美國FDA提交的新藥申請(qǐng)(NDA)是基于一項(xiàng)入組了137例ALS患者的2期臨床試驗(yàn)獲得的積極數(shù)據(jù)���。試驗(yàn)達(dá)到其主要療效終點(diǎn),即根據(jù)修訂的ALS功能評(píng)定量表���,在6個(gè)月隨機(jī)化階段結(jié)束時(shí)���,接受AMX0035治療的ALS患者運(yùn)動(dòng)功能下降顯著減緩。該療法的NDA于2021年12月被FDA接受并獲得優(yōu)先審評(píng)資格�,PDUFA目標(biāo)日期為2022年6月29日。
近來公布的數(shù)據(jù)分析進(jìn)一步表明��,早期使用AMX0035可降低死亡����、氣管切開術(shù)或長久輔助通氣在ALS患者中的發(fā)生率�����。該公司正在進(jìn)行3期臨床試驗(yàn)�����,并在2022年3月在美國為無法參與3期臨床試驗(yàn)的ALS患者啟動(dòng)了AMX0035的擴(kuò)展使用項(xiàng)目(Expanded Access Program)�。如果獲得批準(zhǔn)�����,AMX0035將提供一種新的治療選擇����,可以幫助延遲ALS患者的醫(yī)療干預(yù),例如機(jī)械通氣����。
藥物名稱:AXS-05(右美沙芬+安非他酮)
公司名稱:Axsome Therapeutics
適應(yīng)癥:重度抑郁癥(MDD)
Axsome的AXS-05是一種專有的口服藥物組合,用于治療重度抑郁癥(MDD)�。它由右美沙芬(dextromethorphan)和安非他酮(bupropion)構(gòu)成,并且使用了Axsome公司的代謝抑制技術(shù)��。右美沙芬是一種非競爭性NMDA受體拮抗劑��,它同時(shí)也是sigma-1受體激動(dòng)劑,煙堿型乙酰膽堿受體拮抗劑��,和5-羥色胺和去甲腎上腺素轉(zhuǎn)運(yùn)蛋白的抑制劑��。安非他酮能夠提高右美沙芬的生物利用度�,同時(shí)也是去甲腎上腺素和多巴胺再攝取抑制劑,和煙堿型乙酰膽堿受體拮抗劑����。該公司于2021年提交了該療法的NDA,并獲得了FDA的優(yōu)先審評(píng)資格�����。這一NDA得到了兩項(xiàng)在中重度MDD患者中開展的隨機(jī)雙盲對(duì)照臨床試驗(yàn)的支持(3期臨床試驗(yàn)GEMINI���,2期臨床試驗(yàn)ASCEND)。其中���,在327名中重度MDD成年患者參與的GEMINI試驗(yàn)中��,與安慰劑組相比���,AXS-05迅速且顯著地改善了患者的抑郁癥癥狀���,達(dá)到試驗(yàn)的主要終點(diǎn)。
在Axsome近來和FDA就上市后要求達(dá)成一致后�����,該公司預(yù)計(jì)FDA將在2022年第二季度對(duì)NDA做出回復(fù)����。AXS-05也已獲得用于治療阿爾茨海默病(AD)躁動(dòng)癥狀(agitation)的突破性療法認(rèn)定�����。它目前處于AD躁動(dòng)的3期臨床開發(fā)和戒煙的2期臨床開發(fā)階段��。如果獲得批準(zhǔn)�,該藥物組合將為治療MDD和潛在的其他中樞神經(jīng)系統(tǒng)疾病帶來新的治療方法。
藥物名稱:派安普利單抗
公司名稱:康方生物��、正大天晴(中國生物制藥)
適應(yīng)癥:轉(zhuǎn)移性鼻咽癌
由康方生物與中國生物制藥子公司正大天晴共同開發(fā)的人源化抗PD-1單克隆抗體派安普利單抗(penpulimab)正在等待FDA批準(zhǔn)用于轉(zhuǎn)移性鼻咽癌的三線治療�。BLA于2021年5月提交給FDA,并使用實(shí)時(shí)腫瘤學(xué)審評(píng)(RTOR)試點(diǎn)項(xiàng)目進(jìn)行審評(píng)��。這一項(xiàng)目旨在加快藥物批準(zhǔn)過程���。在美國���,基于有希望的臨床數(shù)據(jù)�����,派安普利單抗已獲得轉(zhuǎn)移性鼻咽癌三線治療的突破性療法認(rèn)定和快速通道資格����,以及治療鼻咽癌的孤兒藥認(rèn)定�����。由于其獨(dú)特的PD-1結(jié)合表位���,該藥物有可能獲得更好的臨床療效�。
聲明:本文版權(quán)歸原作者所有�����,轉(zhuǎn)載文章僅為傳播更多信息�����,如作者信息標(biāo)記有誤�����,或侵犯您的版權(quán)����,請(qǐng)聯(lián)系我們,我們將在及時(shí)修改或刪除內(nèi)容����,聯(lián)系郵箱:marketing@360worldcare.com