日前��,致力于開發(fā)罕見病療法的Zogenix公司宣布���,其口服氟苯丙胺Fintepla(ZX008)�,在治療Lennox-Gastaut綜合征(LGS)患者的關(guān)鍵性3期試驗中���,達到主要研究終點。與安慰劑組相比�,F(xiàn)intepla治療組中患者的癲癇發(fā)作頻率較基線時達到了統(tǒng)計學(xué)意義上的顯著降低。

LGS的發(fā)病通常發(fā)生在3至5歲之間��,有多種病因��,包括腦畸形��,嚴重頭部損傷���,中樞神經(jīng)系統(tǒng)感染���,遺傳性神經(jīng)退行性疾病,或代謝性病癥����。大多數(shù)LGS兒童出現(xiàn)一定程度的智力障礙����,發(fā)育遲緩和異常行為�����。LGS患者通常具有多種癲癇發(fā)作類型���,其中包括痙攣性癲癇發(fā)作�,這導(dǎo)致他們經(jīng)常摔倒和受傷���。對抗癲癇藥物(AEDs)產(chǎn)生耐藥性在LGS患者中很常見�。他們需要新型抗癲癇藥物有效管理癲癇發(fā)作�����。
Zogenix公司開發(fā)的Fintepla是一種液體形態(tài)的氟苯丙胺�����。它可以通過調(diào)節(jié)血清素機制和sigma-1受體活性來減少癲癇發(fā)作的頻率�����。此前,F(xiàn)intepla曾被FDA和歐洲藥品管理局授予用于治療LGS患者的孤兒藥資格�����。目前����,F(xiàn)intepla治療與Dravet綜合征相關(guān)癲癇發(fā)作的新藥申請(NDA)已獲得FDA的優(yōu)先審評資格,預(yù)計將在今年3月25日之前獲得回復(fù)����。
該項名為Study 1601的關(guān)鍵性3期試驗分為兩個部分�。一部分旨在評估將Fintepla添加到LGS患者當前抗癲癇治療方案中的安全性和有效性,共有263名2至35歲的患者參與��。這些患者都曾接受一種或多種抗癲癇藥物的治療�,但疾病未得到良好的控制。他們的中位基線癲癇發(fā)作頻率為每月77次���。在確定基線發(fā)作頻率4周后��,在2周的滴定期內(nèi)將隨機分組的患者服用的藥物劑量調(diào)整至治療劑量�,然后是12周的固定劑量維持期���。完成一部分的患者有資格參加第2部分的臨床試驗���。第二部分試驗是一項為期12個月的開放標簽擴展研究����,旨在評估Fintepla的長期安全性和有效性���。
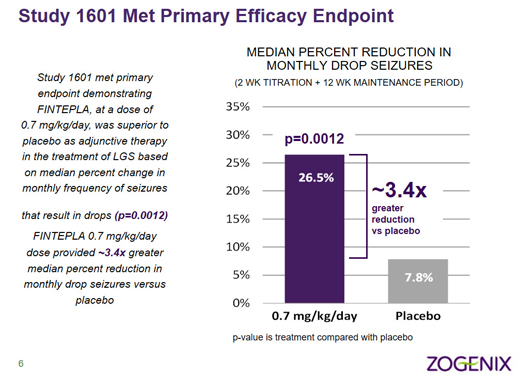
▲Study 1601試驗到達主要終點(圖片來源:參考資料[2])
該試驗的結(jié)果表明���,與安慰劑組相比,F(xiàn)intepla治療組中LGS患者的癲癇發(fā)作頻率較基線時達到了統(tǒng)計學(xué)意義上的顯著降低���,即該試驗的主要終點��。0.7 毫克/公斤/天Fintepla劑量組中患者的中位癲癇發(fā)作頻率減少了26.5%����,而安慰劑組中的這一數(shù)值僅為7.8%����。此外,F(xiàn)intepla治療組中患者在多個次要終點上也顯示出了改善��。
參考資料:
[1] Zogenix Announces Positive Top-line Results from Global Pivotal Phase 3 Trial of FINTEPLA® for the Treatment of Lennox-Gastaut Syndrome,Retrieved February 07, 2020, from https://zogenixinc.gcs-web.com/news-releases/news-release-details/zogenix-announces-positive-top-line-results-global-pivotal-phase
[2] Zogenix Conference Call to Discuss Positive Top-line Results from Global Pivotal Phase 3 Trial of FINTEPLA® for the Treatment of Lennox-Gastaut Syndrome����,Retrieved February 07, 2020, from https://viavid.webcasts.com/viewer/event.jsp?ei=1283978&tp_key=4d9a85d74c
原標題:速遞 | 顯著降低發(fā)作頻率,抗癲癇新藥達到3期主要終點
注:原文有刪減
聲明:本文版權(quán)歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤�����,或侵犯您的版權(quán)���,請聯(lián)系我們�����,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com

