阿斯利康(AstraZeneca)與第一三共制藥(Daiichi Sankyo)近日在2022年美國臨床腫瘤學會(ASCO)年會上公布了關鍵3期DESTINY-Breast04試驗(NCT03734029)的詳細陽性結果���。該試驗是一個對HER2低表達轉移性乳腺癌患者進行HER2靶向治療的3期試驗����,數(shù)據顯示:在先前接受過治療的HER2低表達(定義為:IHC 1+或IHC 2+/ISH-)��、不可切除性和/或轉移性乳腺癌患者中����,無論激素受體(HR)狀態(tài)如何�,與醫(yī)生選擇的化療相比,Enhertu(trastuzumab deruxtecan)治療使無進展生存期(PFS)和總生存期(OS)取得了統(tǒng)計學顯著和臨床意義的改善��。
值得一提的是��,Enhertu是一款在HER2低表達轉移性乳腺癌患者中顯示出生存益處的HER2靶向療法����,有潛力重新定義大約一半乳腺癌患者的臨床治療。Enhertu是一款HER2靶向抗體偶聯(lián)藥物(ADC)���,由阿斯利康與第一三共合作開發(fā)��,該藥正在繼續(xù)重新定義HER2可靶向癌癥的治療��。來自DESTINY-Breast04試驗的數(shù)據已同步發(fā)表于國際醫(yī)學期刊《新英格蘭醫(yī)學雜志》(NEJM)�,詳見:Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer���。
DESTINY-Breast04是一項全球性��、隨機���、開放標簽���、注冊3期試驗,在540例既往已接受了1-2種標準化療治療的HR陽性(n=480)或HR陰性(n=60)����、HER2低表達���、不可切除性和/或轉移性乳腺癌患者中開展���,正在評估Enhertu相對于醫(yī)生選擇的化療方案(卡培他濱、艾立布林�����、吉西他濱�、紫杉醇或白蛋白結合型紫杉醇)的療效和安全性。該試驗中的所有患者都接受了HER2檢測�����,結果經中心實驗室確認為HER2低表達(定義為:IHC 1+或IHC 2+/ISH-)。HER2低表達定義為免疫組織化學(IHC)評分為1+或IHC 2+且原位雜交(ISH)評分為陰性(IHC 1+或IHC 2+/ISH-)��。
據估計�,高達55%的乳腺癌患者腫瘤低表達HER2(IHC 1+或IHC 2+/ISH-),目前這類患者不符合HER2靶向治療的條件����。HER2低表達發(fā)生在HR陽性和HR陰性腫瘤中。HER2檢測已被廣泛用于確定轉移性乳腺癌的適當治療策略����。針對較低范圍的HER2表達可能提供另一種方法來延緩轉移性乳腺癌患者的疾病進展和延長生存期。目前���,對于內分泌(激素)治療進展后HR陽性腫瘤患者和HR陰性患者����,化療仍是一種治療選擇�����。
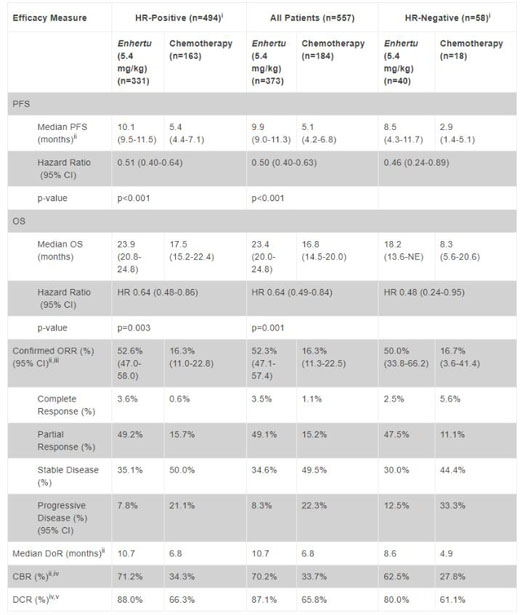
DESTINY-Breast04試驗達到了主要終點:在先前接受過治療的HR陽性HER2低表達轉移性乳腺癌患者中�,與標準護理化療相比����,Enhertu治療顯示出更高的疾病無進展生存期(PFS)����,將疾病進展或死亡風險顯著降低49%(PFS HR=0.51;95%CI:0.40-0.64��;p<0.001)�。根據盲法獨立中心審查(BICR)評估,Enhertu治療組中位PFS為10.1個月���,化療組為5.4個月。
該試驗還達到了關鍵次要終點:在HR陽性疾病患者中����,與標準護理化療相比,Enhertu治療顯示出更高的總生存期(OS)�����,將死亡風險顯著降低36%(OS HR=0.64���;95%CI:0.48-0.86��;p=0.003)���。Enhertu治療組中位OS為23.9個月�,化療組為17.5個月���。
此外��,數(shù)據還顯示���,在HR陽性或HR陰性、HER2呈各種表達水平(IHC 1+和IHC2+/ISH-)的HER2低表達轉移性乳腺癌患者的總體人群中����,Enhertu顯示出一致的療效。BICR評估的PFS關鍵次要終點分析顯示����,在所有患者中,與化療相比��,Enhertu治療將疾病進展或死亡風險降低了50%(PFS HR=0.50�����;95%CI:0.40-0.63;p<0.001)���。結果還顯示�,與化療相比���,Enhertu治療將死亡風險顯著降低了36%(OS HR=0.64����;95%CI:0.49-0.84�����;p=0.001)���;Enhertu治療組的中位OS為23.4個月,化療組為16.8個月��。
對HR陰性疾病患者(n=58)的探索性分析顯示�,Enhertu治療組的中位PFS為8.5個月,化療組為2.9個月(PFS HR=0.46��;95%CI:0.24-0.89)��;Enhertu組的中位OS為18.2個月,化療組為8.3個月(OS HR=0.48�;95%CI:0.24-0.95)。
DESTINY-Breast04試驗結果(圖片來源:阿斯利康官網)
Enhertu的安全性與之前的臨床試驗一致�,未發(fā)現(xiàn)新的安全問題。常見的3級或3級以上治療期不良事件為中性粒細胞減少(13.7%)��、貧血(8.1%)���、疲勞(7.5%)���、白細胞減少(6.5%)、血小板減少(5.1%)和惡心(4.6%)����。間質性肺病(ILD)或肺炎的發(fā)病率與Enhertu的晚期HER2陽性乳腺癌試驗中觀察到的發(fā)病率一致����,獨立裁決委員會確定的5級ILD發(fā)病率較低。大多數(shù)(10%)主要為低級別(1級或2級)����,有5起3級事件(1.3%),無4級事件��,有3起5級事件(0.8%)。
DESTINY-Breast04試驗的調查員��、美國紀念斯隆·凱特林癌癥中心腫瘤內科醫(yī)師Shanu Modi表示示:“DESTINY-Breast04試驗的結果首次表明��,HER2靶向治療可以為HER2低表達患者提供生存益處��,這表明我們必須重新考慮轉移性乳腺癌患者的分類方式�����。Enhertu的療效也增強了為一半以上的乳腺癌患者建立新護理標準的潛力�����,這些患者目前被歸類為HER2陰性疾病����,但實際上是HER2低表達低腫瘤?����!?/span>
阿斯利康腫瘤研發(fā)執(zhí)行副總裁Susan Galbraith表示:“今天的結果代表了一個關鍵時刻��,表明Enhertu有潛力重新定義HER2可靶向性癌癥的治療����。HER2靶向療法從來沒有在HER2低表達轉移乳腺癌患者中顯示出益處。DESTINY-Breast04試驗的歷史性數(shù)據顯示����,在全部HER2低表達轉移性乳腺癌患者中,Enhertu將疾病進展或死亡風險降低一半�、將死亡風險降低三分之一以上。現(xiàn)在��,我們必須改進對轉移性乳腺癌的分類和治療方法�����,以確保HER2低表達患者得到有效的診斷和治療���?���!?/span>
2019年3月����,阿斯利康與第一三共達成了一項總價值69億美元免疫腫瘤學合作,共同開發(fā)Enhertu治療各種HER2表達水平或HER2突變的癌癥患者���,包括胃癌��、結直腸癌和肺癌����、HER2低表達乳腺癌。
Enhertu是一種新一代ADC藥物����,通過一種4肽鏈接子將靶向HER2的人源化單克隆抗體trastuzumab(曲妥珠單抗)與一種新型拓撲異構酶1抑制劑exatecan衍生物(DX-8951衍生物,DXd)鏈接在一起����,可靶向遞送細胞毒制劑至癌細胞內,與通常的化療相比�����,可減少細胞毒制劑的全身暴露����。
截至目前,Enhertu(5.4mg/kg)已在多個國家被批準:作為單藥療法���,用于治療在轉移性疾病中接受過2種或2種以上抗HER2治療方案的不可切除性或轉移性HER2陽性乳腺癌成人患者�。此外���,Enhertu(6.4mg/kg)也已在多個國家被批準:用于治療先前接受了曲妥珠單抗方案的局部晚期或轉移性HER2陽性胃或胃食管連接部(GEJ)腺癌成人患者�����。
乳腺癌是女性中常見的癌癥類型��,也是女性癌癥相關死亡的首要原因之一���。乳腺癌病例中大約20%為HER2陽性,盡管近年來已取得治療進展并有多款新藥獲批��,但在HER2陽性轉移性乳腺癌患者中仍存在著顯著的臨床需求��。這種疾病仍然是無法治愈的���,患者在接受目前可用的療法后終會病情進展�����。HER2是一種酪氨酸激酶受體促生長蛋白�����,表達于多種腫瘤細胞表面�����,包括胃癌����、乳腺癌、肺癌和結直腸癌�,與侵襲性疾病和預后較差相關。
聲明:本文版權歸原作者所有����,轉載文章僅為傳播更多信息,如作者信息標記有誤����,或侵犯您的版權,請聯(lián)系我們����,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com