三個(gè)月打一針�����!這種活不過5年的罕見病,迎來新型療法
遺傳性轉(zhuǎn)甲狀腺素淀粉樣變性(hATTR)是一種可遺傳的退行性致命性疾病,由TTR基因突變導(dǎo)致��。
進(jìn)行性神經(jīng)病變和心肌病為該疾病主要特征��。該病具有很高的死亡率���,確診后的中位生存期為4.7年��,有心肌病特征患者生存期更低(3.4年)��。
2018年,一款RNAi藥物Patisiran(Onpattro)獲FDA批準(zhǔn)����,成為一個(gè)治療遺傳性轉(zhuǎn)甲狀腺素蛋白淀粉樣變性伴多發(fā)性神經(jīng)病(hATTR-PN)患者的藥物。Onpattro通過阻斷TTR蛋白的生成來發(fā)揮作用�,但需每3周靜脈給藥一次。
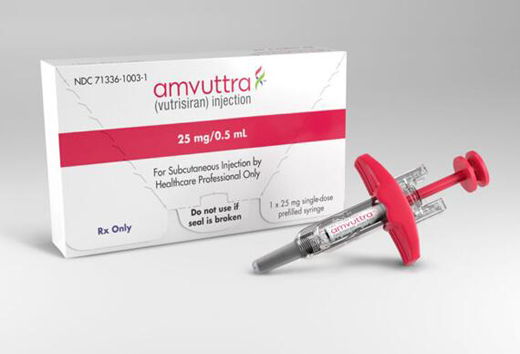
近日�����,美國FDA已批準(zhǔn)Amvuttra(Vutrisiran)用于治療hATTR-PN成人患者�。
Amvuttra每3個(gè)月皮下注射一次,是一款可逆轉(zhuǎn)神經(jīng)病變損傷的療法����。
Amvuttra是一種雙鏈小干擾RNA(siRNA),靶向突變型和野生型轉(zhuǎn)甲狀腺素蛋白(TTR)信使RNA(mRNA)����。減少TTR淀粉樣蛋白在組織中的沉積����,促進(jìn)組織中沉積的TTR淀粉樣蛋白的清除,并恢復(fù)這些組織的功能�����。
FDA的批準(zhǔn)是基于一項(xiàng)全球隨機(jī)���、開放標(biāo)簽III期研究的積極結(jié)果����,該研究評(píng)估了Amvuttra在不同組hATTR-PN患者中的療效和安全性���。
164名患者以3:1的比例隨機(jī)接受Amvuttra或Patisiran治療����,持續(xù)18個(gè)月。
結(jié)果顯示�,Amvuttra達(dá)到研究的主要終點(diǎn)。
◎Amvuttra組改良神經(jīng)病變損害評(píng)分+7較基線平均降低(改善)2.2分�,而安慰劑組平均升高(惡化)14.8分;
◎第9個(gè)月時(shí),Amvuttra顯著改善了多神經(jīng)病變的癥狀和體征����,50%的患者疾病表現(xiàn)停止或逆轉(zhuǎn);
◎Amvuttra在第18個(gè)月的療效結(jié)果與第9個(gè)月的數(shù)據(jù)一致;
◎Amvuttra安全性和耐受性良好,未發(fā)生藥物相關(guān)停藥或死亡事件�。
據(jù)了解,Amvuttra 25mg/0.5mL單劑量預(yù)裝注射劑型預(yù)計(jì)將于2022年7月上市��。
FDA此次的批準(zhǔn)對(duì)hATTR患者來說非常鼓舞人心���,他們亟需新的���、更便利的療法來治療這種進(jìn)行性、危機(jī)生命的疾病�����。Amvuttra有望成為新的標(biāo)準(zhǔn)療法�。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息�,如作者信息標(biāo)記有誤�����,或侵犯您的版權(quán)�,請(qǐng)聯(lián)系我們��,我們將在及時(shí)修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com