DNA為本:熊巍團(tuán)隊(duì)通過(guò)在體基因編輯治療遺傳性耳聾
北京腦科學(xué)與類(lèi)腦研究中心(CIBR)熊巍實(shí)驗(yàn)室在 Cell 子刊 Cell Reports 上發(fā)表了題為:Template-independent genome editing in the Pcdh15 av-3j mouse, a model of human DFNB23 nonsyndromic deafness(不依賴(lài)于修復(fù)模板的基因編輯應(yīng)用于Pcdh15av-3j小鼠品系,一個(gè)人類(lèi)非綜合性耳聾DFNB23的動(dòng)物模型)���。
首次在哺乳動(dòng)物模型上展示了利用非同源末端連接(NHEJ)的基因修復(fù)通路有效實(shí)現(xiàn)先天性遺傳疾病的在體基因治療�����。
DNA水平基因修復(fù)成為下一代基因治療新方向
基因治療是治療基因突變導(dǎo)致的遺傳性疾病的金鑰匙����,目前大部分工作集中在針對(duì)mRNA的基因替代(Gene replacement)或者基因沉默(Gene silence),若干適用性好的靶基因已經(jīng)被用于臨床�,體現(xiàn)出基因治療的可行性。然而就中心法則而言��,在mRNA水平的修復(fù)還是治標(biāo)不治本�����,因此針對(duì)DNA的基因修復(fù)代表了下一代基因治療的新方向�����,本研究提出特別針對(duì)DNA移碼突變的一個(gè)方案����,并系統(tǒng)展示了在耳蝸毛細(xì)胞DNA水平的基因編輯有效恢復(fù)動(dòng)物聽(tīng)覺(jué)。
DNA水平的基因修復(fù)是以CRISPR-Cas為代表的基因編輯技術(shù)來(lái)實(shí)現(xiàn)��,隨著2011年CRISPR-Cas工具的開(kāi)發(fā)成熟�,研究者可以依賴(lài)guide RNA(gRNA)實(shí)現(xiàn)穩(wěn)定可控的定點(diǎn)DNA雙鏈切割/斷裂(DSB),CRISPR-Cas技術(shù)的一個(gè)重要應(yīng)用就是實(shí)現(xiàn)定點(diǎn)切除致病突變��。DSB的修復(fù)有諸多通路�,其中主要的是NHEJ和同源重組修復(fù)(HDR)兩種:NHEJ產(chǎn)物攜帶各種插入或者缺失(InDel)導(dǎo)致的移碼突變����,其結(jié)果等同于從一個(gè)突變到多種突變�����,因此沒(méi)有得到基因治療的很好應(yīng)用�����;依賴(lài)HDR修復(fù)通路將靶基因修復(fù)為野生型����,但是這一過(guò)程需要有一個(gè)野生型的DNA模板���,然而在體情況下基于HDR通路的修復(fù)效率在活體動(dòng)物的終端分化細(xì)胞上效率非常低�,從一定程度上限制了基因編輯在基因治療上的應(yīng)用��。因此基于基因編輯技術(shù)的在體基因治療方案一直處于實(shí)驗(yàn)室和細(xì)胞系體系研究階段�。
首次在哺乳動(dòng)物模型上展示了利用NHEJ基因修復(fù)通路實(shí)現(xiàn)先天性遺傳疾病的在體基因治療
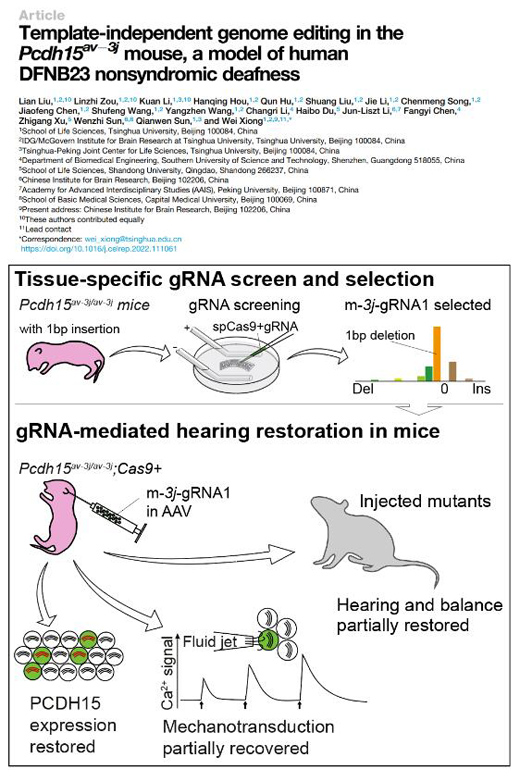
自2016年以來(lái),陸續(xù)有基于細(xì)胞系的研究表明gRNA-spCas9酶切割產(chǎn)生的DSB的末端連接產(chǎn)物并非隨機(jī)�,而是可以預(yù)測(cè)和重復(fù)實(shí)現(xiàn)的,那么基于這一原理��,對(duì)于某一個(gè)gRNA所獲得DNA編輯事件可以預(yù)測(cè),反過(guò)來(lái)說(shuō)可以根據(jù)DNA產(chǎn)物需要來(lái)選擇gRNA�。然而這一規(guī)律在體內(nèi)的實(shí)際情況是怎么樣的并不知道,該研究即利用小鼠耳蝸培養(yǎng)組織驗(yàn)證了終端分化的功能細(xì)胞上編輯產(chǎn)物也具有可重復(fù)性���,并利用該原理實(shí)現(xiàn)了單個(gè)gRNA即可修復(fù)移碼突變���,實(shí)現(xiàn)小鼠的在體基因治療。
本研究展示了接收聲音振動(dòng)的聽(tīng)覺(jué)毛細(xì)胞可以利用內(nèi)源性DNA修復(fù)通路中的主要方式NHEJ(大于90%)修復(fù)InDel導(dǎo)致的移碼突變���,在遺傳性耳聾動(dòng)物模型(Pcdh15av-3j小鼠�,攜帶一個(gè)腺苷的插入突變)上實(shí)現(xiàn)了導(dǎo)入單個(gè)gRNA有效修復(fù)該插入導(dǎo)致的遺傳性耳聾���,而PCDH15蛋白是毛細(xì)胞tip link的組分�����,是毛細(xì)胞機(jī)械轉(zhuǎn)導(dǎo)通道開(kāi)放的關(guān)鍵蛋白���,蛋白質(zhì)量有215kD之巨。該概念的成功驗(yàn)證提示占人類(lèi)22%的移碼突變導(dǎo)致的遺傳性疾病有廣闊的治療前景�。
從體外組織和在體動(dòng)物兩個(gè)層面展示通過(guò)NHEJ通路實(shí)現(xiàn)移碼突變的修復(fù)以及聽(tīng)覺(jué)和平衡覺(jué)功能的部分修復(fù)
熊巍實(shí)驗(yàn)室長(zhǎng)期研究耳聾相關(guān)基因的生理和病理機(jī)制,本工作利用一株模擬人類(lèi)DFNB23遺傳性耳聾的Pcdh15av-3j小鼠品系,全方位系統(tǒng)的展示了突變位點(diǎn)附近產(chǎn)生的DSB可以通過(guò)NHEJ通路實(shí)現(xiàn)移碼突變的修復(fù)以及聽(tīng)覺(jué)和平衡覺(jué)功能的部分修復(fù)����。本研究在體外組織和在體動(dòng)物兩個(gè)層面,從編輯基因產(chǎn)物��、蛋白表達(dá)�、毛細(xì)胞功能、以及動(dòng)物生理功能等多個(gè)角度的分析和評(píng)估來(lái)展現(xiàn)該方案的可行性�。
組織層面:
耳蝸毛細(xì)胞的基因遞送一直是一個(gè)難點(diǎn)�����,熊巍博士早前開(kāi)發(fā)了一套耳蝸組織培養(yǎng)和基因電轉(zhuǎn)遞送的系統(tǒng)解決方案(Xiong et al., Nat. Protoc. 2014)���,實(shí)現(xiàn)在培養(yǎng)的耳蝸組織上通過(guò)電轉(zhuǎn)(較大規(guī)模)向毛細(xì)胞導(dǎo)入外源基因�,后續(xù)通過(guò)電生理或者鈣成像研究特定基因干預(yù)后的毛細(xì)胞功能變化�。基于該耳蝸電轉(zhuǎn)技術(shù)�,熊巍實(shí)驗(yàn)室首先掃描了av-3j突變(1bp插入)上下游15bp的區(qū)域內(nèi)的4條gRNA所產(chǎn)生的編輯產(chǎn)物,發(fā)現(xiàn)其中的m-3j-gRNA1表現(xiàn)出高比例的1bp刪除的編輯產(chǎn)物�����,而且重復(fù)性很高,意味著m-3j-gRNA1是一個(gè)潛在的治療av-3j突變的備選gRNA����。在培養(yǎng)的Pcdh15av-3j耳蝸組織上,通過(guò)電轉(zhuǎn)表達(dá)了spCas9和m-3j-gRNA1的Pcdh15av-3j毛細(xì)胞可以恢復(fù)PCDH15蛋白的表達(dá)(Pcdh15av-3j突變導(dǎo)致PCDH15不表達(dá)上膜)���,同時(shí)Pcdh15av-3j毛細(xì)胞的機(jī)械轉(zhuǎn)導(dǎo)功能也有所恢復(fù)�。有意思的是����,在包括-1bp、-4bp����、+2bp等在內(nèi)的回碼(frame-restored)產(chǎn)物類(lèi)別中,其較高占比產(chǎn)物均對(duì)PCDH15功能有明顯恢復(fù)����,提示蛋白修復(fù)產(chǎn)物在非保守區(qū)即使1-2氨基酸的插入或者刪除并非絕對(duì)無(wú)功能,從轉(zhuǎn)化角度考慮也是值得去開(kāi)發(fā)的一種可能性����。
在體層面:
根據(jù)體外研究的效果,熊巍實(shí)驗(yàn)室進(jìn)一步對(duì)Pcdh15av-3j小鼠在體耳蝸?zhàn)⑸浒衜-3j-gRNA1的AAV2/9���。通過(guò)對(duì)電轉(zhuǎn)耳蝸組織(體外)和病毒注射耳蝸組織(在體)的基因編輯產(chǎn)物進(jìn)行的系統(tǒng)比對(duì)�����,發(fā)現(xiàn)它們無(wú)論是在主編輯產(chǎn)物還是產(chǎn)物的比例上均非常一致���。進(jìn)一步的對(duì)m-3j-gRNA1病毒注射小鼠的各方面指標(biāo)的評(píng)估�����,包括耳蝸毛細(xì)胞的PCDH15表達(dá)(蛋白表達(dá))�、耳蝸毛細(xì)胞的機(jī)械轉(zhuǎn)導(dǎo)電流(細(xì)胞功能)�����、小鼠的聽(tīng)性腦干電位(ABR���,聽(tīng)覺(jué)生理)和驚嚇?lè)磻?yīng)(Startle,行為學(xué))等��,均顯示單個(gè)m-3j-gRNA1在spCas9的幫助下即可實(shí)現(xiàn)av3j突變的功能性恢復(fù)��。熊巍實(shí)驗(yàn)室同時(shí)也檢驗(yàn)了前庭器官的恢復(fù)效果���,結(jié)果顯示Pcdh15av-3j小鼠在注射m-3j-gRNA1后也得到了平衡功能的恢復(fù)��。
為基于基因編輯技術(shù)的在體基因治療提供進(jìn)一步支持
基因藥是繼化學(xué)藥之后的基礎(chǔ)和臨床各機(jī)構(gòu)研發(fā)的下一代藥物的重點(diǎn)方向���,在人體基因遞送和基因表達(dá)等技術(shù)門(mén)檻陸續(xù)解決的情況下����,遺傳性疾病的基因治療的前景越來(lái)越明確�。2012年CRISPR-Cas技術(shù)的橫空出世,提供了有效且實(shí)用的DNA編輯工具�����,讓面向DNA的在體基因治療成為可能���?;瘜W(xué)藥和基因替代/沉默等手段通常只能做到治標(biāo)不治本�����,而面向DNA的基因編輯帶來(lái)的基因修復(fù)�,可以讓被修復(fù)基因跟隨生命體的生長(zhǎng)節(jié)奏在時(shí)間上和空間上實(shí)現(xiàn)內(nèi)源表達(dá)調(diào)控,是自然的基因表達(dá)和調(diào)控的體現(xiàn)����,也應(yīng)該是理想的針對(duì)遺傳性疾病的修復(fù)方式��。
研究歷程
熊巍實(shí)驗(yàn)室在2015年建立實(shí)驗(yàn)室之時(shí)即確立了研究遺傳性耳聾基因治療的方向����,所有的技術(shù)和資源都是從零開(kāi)始積累���,期間嘗試了多種策略和方法�����,終鎖定利用到NHEJ的非隨機(jī)修復(fù)機(jī)制來(lái)重塑移碼突變導(dǎo)致的致聾突變����。本工作從2019年底投稿到2022年上半年終接收��,歷時(shí)2年半�����,不可謂不艱難���,不過(guò)“凡是過(guò)去���,皆為序章”!
該論文的共同作者為劉戀���、鄒林志和李寬三位博士研究生��,本工作也得到南方科技大學(xué)陳放怡實(shí)驗(yàn)室��、山東大學(xué)徐志剛實(shí)驗(yàn)室和清華大學(xué)孫前文實(shí)驗(yàn)室的大力協(xié)助��,論文通訊作者為熊巍��。
聲明:本文版權(quán)歸原作者所有��,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤��,或侵犯您的版權(quán)���,請(qǐng)聯(lián)系我們,我們將在及時(shí)修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com