羅氏“不限癌種”療法「恩曲替尼」在中國獲批
7月29日,中國國家藥監(jiān)局(NMPA)官網公示顯示�����,羅氏(Roche)公司申報的恩曲替尼(entrectinib)膠囊已在中國獲批�。公開資料顯示,恩曲替尼是一款針對NTRK和ROS1基因融合而設計的特異性酪氨酸激酶抑制劑����,本次申請用于治療NTRK融合陽性局部晚期或轉移性實體瘤��。
截圖來源:NMPA官網
NTRK融合陽性腫瘤產生的原因是NTRK1/2/3基因與其它基因融合��,導致編碼的TRK蛋白(TRK A/B/C)出現(xiàn)異常�����,激活與特定癌癥增殖相關的信號通路�。NTRK基因融合可能出現(xiàn)在起源于身體不同位置的腫瘤中,包括乳腺癌����、膽管癌���、結直腸癌、神經內分泌癌��、非小細胞肺癌�、胰腺癌等等。
恩曲替尼是羅氏開發(fā)的一款針對NTRK和ROS1基因融合而設計的特異性酪氨酸激酶抑制劑��,它能夠抑制TRK A/B/C和ROS1激酶活性����。2019年6月,恩曲替尼獲得日本厚生勞動省批準����,治療攜帶NTRK基因融合的晚期復發(fā)實體瘤患者。隨后該藥又獲得美國FDA加速批準���,用于治療攜帶NTRK基因融合的成年和青少年癌癥患者�,以及攜帶ROS1基因突變的非小細胞肺癌患者����,成為了FDA批準的第三款“不限癌種”的抗癌療法。
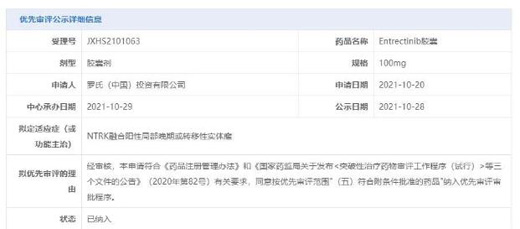
2021年10月����,中國國家藥品監(jiān)督管理局藥品審評中心(CDE)受理了恩曲替尼膠囊的上市申請�����,并將其納入優(yōu)先審評���。根據優(yōu)先審評公示信息,該藥本次申請擬用于治療NTRK融合陽性局部晚期或轉移性實體瘤�����。
截圖來源:CDE官網
恩曲替尼治療NTRK融合陽性局部晚期或轉移性實體瘤的效果已在多項臨床試驗中得到驗證�����,其中包括名為STARTRK-2的關鍵性2期臨床試驗���,以及名為STARTRK-1和ALKA-372-001的1期臨床試驗。對這些試驗數(shù)據的匯總分析表明:
在NTRK融合陽性實體瘤患者中�,接受恩曲替尼治療的患者客觀緩解率(ORR)為57.4%,中位緩解持續(xù)時間(DOR)為10.4個月�;
多達10種不同類型的實體瘤患者對這一療法產生響應;
對于腫瘤轉移到大腦的實體瘤患者�����,恩曲替尼也能達到54.5%的顱內客觀緩解率,獲得緩解的患者中四分之一達到完全緩解�����。
希望羅氏的恩曲替尼早日來到患者身邊��,讓他們擁有新的治療選擇�。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息�����,如作者信息標記有誤�,或侵犯您的版權,請聯(lián)系我們�,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com