Amylyx “漸凍癥” 新療法獲FDA批準上市
據(jù)外媒Endpoints���、fiercepharma以及ALS協(xié)會官網(wǎng)報道��,F(xiàn)DA已于9月29日批準Amylyx公司Relyvrio(苯丁酸鈉和?����;撬岫伎诜潭▌┝颗浞?,AMX0035)用于治療肌萎縮側(cè)索硬化(ALS)成人患者,商品名為Relyvrio��。該藥物是首款在隨機�����、安慰劑對照臨床試驗中顯著延緩ALS疾病進展并能延長生存期的治療藥物����,也是116年以來FDA批準的第3款ALS治療藥物。
目前還沒有關于價格的信息�,Relyvrio在加拿大的售價約為16.3萬美元,該藥于今年6月獲加拿大衛(wèi)生部有條件獲批��,商品名Albrioza�,是Albrioza在全球范圍內(nèi)的首次批準上市(見:全球首批!“漸凍人”癥迎來創(chuàng)新療法)���。
ALS協(xié)會也在慶祝這一批準���。 該協(xié)會在一份聲明中表示,該組織將2014年ALS冰桶挑戰(zhàn)籌得的220萬美元投資于這種藥物的研發(fā)���。它還領導了長達數(shù)年的宣傳運動����,以使這一療法獲得批準,包括在2020年9月向FDA提交了超過5萬個簽名�����,呼吁該機構(gòu)批準該藥物���。
分析人士預計,盡管Relyvrio的患者人數(shù)相對較少�,但其銷售情況還是會比較強勁。假設其定價與加拿大相似���,Relyvrio的銷售額可能達到每年8億美元左右的峰值�。不過�����,考慮到所需的時間�����,Amylyx可能需要一兩年的時間才能實現(xiàn)這一目標。預計Relyvrio 2023年的銷售額將達到5.45億美元����。
肌萎縮側(cè)索硬化癥(簡稱ALS),俗稱“漸凍癥”��,這是一種不可逆的致死性運動神經(jīng)元病���,主要癥狀為四肢和軀干肌肉表現(xiàn)進行性加重的肌肉無力和萎縮�����,逐漸失去運動功能��,像被“凍住”一般�,所以俗稱“漸凍人”���。該病一般進展迅速���,半數(shù)以上患者確診后平均生存時間為3-5年,至后多死于呼吸肌無力導致的呼吸衰竭���。據(jù)估計��,ALS在全球范圍內(nèi)的發(fā)病率約為十萬分之二��。
FDA分別于上世紀90年代和2017年批準了另外兩款ALS治療藥物利魯唑和依達拉奉�,但它們對功能、生存和癥狀管理的影響不大��。今年早些時候����,F(xiàn)DA還批準了依達拉奉的一種新的口服制劑,該藥物此前通常是通過靜脈輸液給藥�。
目前,ALS的發(fā)病機制尚不明確����,科學家普遍認為其病因是基因與環(huán)境共同作用的結(jié)果���。較為常見的ALS致病基因包括SOD1��,TDP-43����,研究顯示�,25.6%~30.6%的家族性ALS患者有SOD1突變����。其它可能的發(fā)病機制包括RNA加工異常����、谷氨酸興奮性毒性、細胞骨架排列紊亂�、線粒體功能障礙、病毒感染�����、細胞凋亡��、生長因子異常����、炎癥反應等。
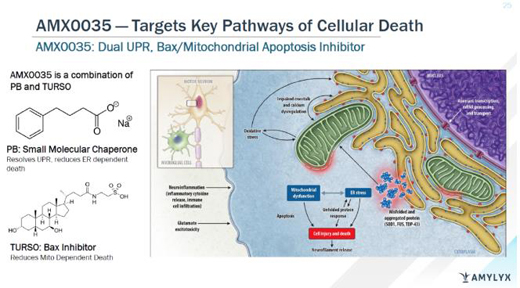
Albrioza(AMX0035)是一種由苯丁酸鈉(sodium phenylbutrate��,PB)和?;撬岫迹╰aurursodiol,TURSO�����,又名ursodoxicoltaurine)組成的專有口服固定劑量復方制劑。PB是一種小分子伴侶�����,旨在減少未折疊蛋白反應(UPR)���,防止因UPR導致的細胞死亡�。TURSO是一種Bax抑制劑���,旨在通過凋亡減少細胞死亡����。PB和TURSO在固定劑量配方中聯(lián)合使用��,靶向肌萎縮側(cè)索硬化癥(ALS)和其他神經(jīng)退行性疾病中的內(nèi)質(zhì)網(wǎng)和線粒體依賴性神經(jīng)元退行性變通路�,減少神經(jīng)元死亡和功能障礙。
AMX0035組成及作用機制
2022年3月�,PCNSDAC以6:4的投票��,表達了對AMX0035現(xiàn)有數(shù)據(jù)說服力的懷疑——包括試驗規(guī)模小�、缺失數(shù)據(jù)、用于分析主要終點的統(tǒng)計方法的適當性以及隨機化方案等問題�。這些終指向了一個結(jié)論——II期結(jié)果雖然具有統(tǒng)計學意義�����,但仍不足以確定AMX0035可以改善疾病進展�。
在II期CENTAUR試驗中�����,研究人員在137名ALS患者中測試了AMX0035與安慰劑為期六個月的治療效果����,研究的主要終點是ALS功能評定量表總分的下降率。結(jié)果顯示����,接受AMX0035治療的患者平均得分高出2.32分,下降速度減緩25.3%�,具有統(tǒng)計學意義。長期隨訪研究表示��,3年左右時AMX0035仍可表現(xiàn)一定生存益處���。與安慰劑相比�����,AMX0035可將死亡風險降低約44%��。但在6個月的隨機期間��,Amylyx沒有發(fā)現(xiàn)統(tǒng)計學上顯著的生存差異�����。
2022年6月�,F(xiàn)DA通知Amylyx,將AMX0035的PDUFA日期延長至2022年9月29日��,以便有更多時間審查AMX0035臨床研究數(shù)據(jù)的額外分析���。2022年9月8日��,F(xiàn)DA外周和中樞神經(jīng)系統(tǒng)藥物咨詢委員會(PCNSDAC)以7:2的投票結(jié)果贊成該公司在研藥物AMX0035的現(xiàn)有研究數(shù)據(jù)足以支持其用于治療肌萎縮側(cè)索硬化的上市申請�����。PCNSDAC的投票結(jié)果雖不具有約束力�,但本次FDA批準AMX0035的上市申請應予以考慮了專家組的建議��。
AMX0035在ALS患者中的III期臨床試驗正在進行中�,計劃于2023年底或2024年年初完成。
下一個ALS新藥可能也會很快到來���,今年7月渤健和Ionis的在研反義寡核苷酸療法tofersen(BIIB067)上市申請已獲FDA受理��,用于治療超氧化物歧化酶1 (SOD1)突變所致的ALS���。FDA同時授予其優(yōu)先審評資格,PDUFA日期定于2023年1月25日�����。
與 Amylyx 一樣����,Biogen也面臨著關于其數(shù)據(jù)質(zhì)量的問題。與安慰劑相比�,Tofersen在ALS評定量表上未能達到統(tǒng)計學意義,但Biogen正試圖利用替代終點生物標志物贏得批準����。通過降低患者血液和腦脊液中被稱為神經(jīng)絲蛋白的蛋白質(zhì),Biogen認為tofersen的作用很可能轉(zhuǎn)化為臨床獲益���。
聲明:本文版權歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息����,如作者信息標記有誤���,或侵犯您的版權�,請聯(lián)系我們�����,我們將在及時修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com