現(xiàn)貨型T細(xì)胞療法獲CHMP支持���,有望年底上市
10月14日,Atara和Pierre Fabre宣布�,歐洲藥品管理局(EMA)人用藥品委員會(huì)(CHMP)對(duì)其現(xiàn)貨型T細(xì)胞療法Ebvallo(tabelecleucel)的上市申請(qǐng)給予積極意見,建議歐洲委員會(huì)(EC)批準(zhǔn)該產(chǎn)品單藥用于治療兩歲以上兒童和成人復(fù)發(fā)或難治性Epstein-Barr病毒陽性移植后淋巴增生性疾?�。‥BV+ PTLD)�����,這些患者既往至少接受過一次治療����。如果獲得批準(zhǔn),Ebvallo將成為全球一款獲批的同種異體T細(xì)胞療法����。
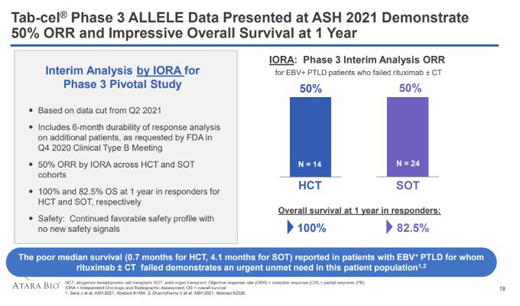
EBV+PTLD是一種罕見、急性且可能致命的血液系統(tǒng)惡性腫瘤�����。當(dāng)移植后患者的T細(xì)胞活性因免疫抑制而受損時(shí),可引發(fā)此類疾病����。接受實(shí)體器官移植(SOT)或同種異體HCT的患者均會(huì)受此疾病影響����。HCT和SOT后經(jīng)利妥昔單抗±化療失敗的EBV+PTLD患者的中位生存期僅為0.7個(gè)月和4.1個(gè)月?��;颊邔?duì)有效��、安全和快速起效的新型治療方案具有迫切需求�。
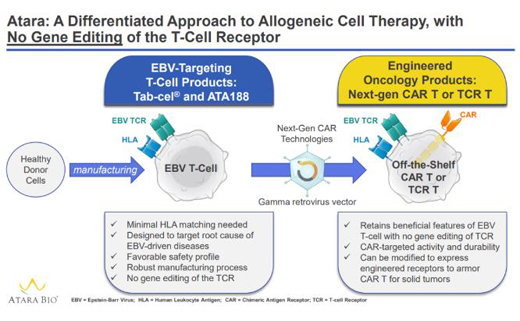
Ebvallo是一種異基因EBV特異性T細(xì)胞免疫療法��,它以HLA限制的方式靶向并消除EBV感染細(xì)胞�����。Ebvallo已被美國FDA授予治療利妥昔單抗難治性EBV相關(guān)淋巴增生性疾?。↙PD)的突破性療法資格和孤兒藥稱號(hào)。
CHMP的積極意見是基于關(guān)鍵III期ALLELE研究結(jié)果�����。在這項(xiàng)研究中,Ebvallo顯示出了良好的風(fēng)險(xiǎn)-收益比�����。截至2021年5月��,24例利妥昔單抗+化療治療失敗的SOT后EBV+PTLD患者和14例利妥昔單抗單藥治療失敗的HCT后EBV+PTLD患者接受了Ebvallo治療��,并有機(jī)會(huì)進(jìn)行6個(gè)月的隨訪����。
通過獨(dú)立腫瘤反應(yīng)判定(IORA)評(píng)估,HCT組和SOT組的ORR為50% (19/ 38,95%CI: 33.4, 66.6)����。完全緩解(CR)率為26.3%,部分緩解(PR)率為23.7%��。所有患者的中位緩解時(shí)間(TTR)為1.1個(gè)月(0.7-4.7)����。
達(dá)到CR和PR患者的2年總生存率相當(dāng),分別為86%和87%����,中位總生存期(OS)約為55個(gè)月����。
鑒于CHMP的積極意見�����,歐盟委員會(huì)預(yù)計(jì)將在2022年底前批準(zhǔn)Ebvallo的上市許可申請(qǐng)(MAA)���。 如果獲得歐盟的批準(zhǔn),集中銷售授權(quán)將在所有歐盟成員國以及冰島���、列支敦士登和挪威有效���。此外,Atara將根據(jù)歐委會(huì)決策依賴程序(EC DRP)向英國藥品和保健品監(jiān)管局(MHRA)提交MAA�,預(yù)計(jì)在2022年底前獲得批準(zhǔn)。根據(jù)現(xiàn)有的合作協(xié)議��,Pierre Fabre將領(lǐng)導(dǎo)歐洲的所有商業(yè)化和分銷活動(dòng)���。
Atara總裁兼執(zhí)行官Pascal Touchon說“今日CHMP的積極意見是Atara公司first-in-class產(chǎn)品向前邁出的重要一步���,該產(chǎn)品能夠治療一種超罕見和侵襲性癌癥��,這一疾病目前沒有獲得批準(zhǔn)的療法�����。同時(shí)這為我們獨(dú)特的同種異體EBV T細(xì)胞平臺(tái)提供進(jìn)一步驗(yàn)證�。如果獲得批準(zhǔn)���,Ebvallo將成為一款同種異體T細(xì)胞療法��,并有可能改變復(fù)發(fā)或難治性EBV+PTLD患者的治療模式�,這些患者預(yù)后不良���,中位生存期僅為幾周至幾個(gè)月��?���!?/span>
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息�����,如作者信息標(biāo)記有誤�,或侵犯您的版權(quán),請(qǐng)聯(lián)系我們�����,我們將在及時(shí)修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com