再生元(Regeneron)近日宣布�,歐洲藥品管理局(EMA)人用醫(yī)藥產(chǎn)品委員會(CHMP)已發(fā)布一份積極審查意見����,建議批準(zhǔn)抗PD-1療法Libtayo(cemiplimab):作為一種單藥療法,用于治療鉑類化療期間或之后疾病進展的復(fù)發(fā)或轉(zhuǎn)移性宮頸癌成人患者��。歐盟委員會(EC)將審查CHMP的意見����,并預(yù)計在未來2個月內(nèi)做出終審查決定。
CHMP的積極審查意見�,基于3期臨床試驗EMPOWER-Cervical 1(NCT03257267)的結(jié)果。這是在晚期宮頸癌開展的大規(guī)模臨床試驗�,入組了先前接受含鉑化療治療后疾病進展的復(fù)發(fā)或轉(zhuǎn)移性宮頸癌患者,不論PD-L1表達狀態(tài)或組織學(xué)如何�。研究中,將Libtayo單藥療法與研究調(diào)查員選擇的化療進行了對比。
結(jié)果顯示�,該試驗達到了總生存期(OS)主要終點:無論PD-L1表達狀態(tài)或腫瘤組織學(xué)如何,與二線化療相比���,Libtayo治療均顯著改善OS�����,在整個患者群體中將死亡風(fēng)險降低31%(HR=0.69���,單側(cè)p<0.001),在鱗狀細(xì)胞癌(SCC)患者中將死亡風(fēng)險降低27%(HR=73�;95%CI:0.58-0.91;單側(cè)p=0.003)���。該試驗的詳細(xì)數(shù)據(jù)已于2022年2月發(fā)表于國際醫(yī)學(xué)期刊《新英格蘭醫(yī)學(xué)雜志》(NEJM)�。詳見:Survival with Cemiplimab in Recurrent Cervical Cancer����。
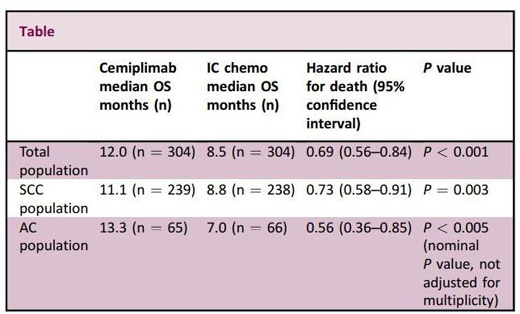
EMPOWER-Cervical 1臨床試驗數(shù)據(jù)(圖片來源:NEJM)
EMPOWER-Cervical 1是一項開放標(biāo)簽、隨機��、多中心��、3期臨床試驗,在接受含鉑化療后病情進展的復(fù)發(fā)或轉(zhuǎn)移性宮頸癌患者中開展��,將Libtayo單藥療法與研究者選擇的化療方案進行了比較��。無論患者腫瘤PD-L1表達情況如何均可入組�����,78%的患者為鱗狀細(xì)胞癌(SCC)����,22%的患者為腺癌(AC)���。
這是晚期宮頸癌治療方面開展的大規(guī)模3期隨機臨床試驗����,共入組了全球14個國家的608例女性患者(中位年齡:51歲)����。這些患者被隨機分為Libtayo單藥治療組(n=304;每3周一次���,350毫克)或研究者選擇的常用化療方案組(n=304�;培美曲塞、長春瑞濱�、拓?fù)涮婵怠⒁亮⑻婵祷蚣魉麨I)�����。與化療組相比����,Libtayo治療組患者經(jīng)歷了:
——在整個研究群體(SCC+AC)中:(1)死亡風(fēng)險降低了31%,Libtayo治療組(n=304)中位生存期為12.0個月�、化療組(n=304)為8.5個月,數(shù)據(jù)具有統(tǒng)計學(xué)顯著差異(HR=0.69����;95%CI:0.56-0.84;雙側(cè)p<0.001)�。(2)疾病進展風(fēng)險降低25%(HR=0.75;95%CI:0.63-0.89�;雙側(cè)p<0.001)。(3)ORR顯著提高(16.4% vs 6.3%����;雙側(cè)p<0.001)、中位緩解持續(xù)時間(DOR)顯著延長(16.4個月 vs 6.9個月)����。
——在鱗狀細(xì)胞癌群體(SCC)中:(1)死亡風(fēng)險降低27%��,Libtayo治療組(n=239)中位生存期為11.1個月���、化療組(n=238)為8.8個月,數(shù)據(jù)具有統(tǒng)計學(xué)顯著差異(HR=0.73�����;95%CI:0.58-0.91�;雙側(cè)p=0.006)。(2)疾病進展風(fēng)險降低29%(HR=0.71���;95%CI:0.58-0.86;雙側(cè)p<0.001)����。(3)ORR提高(17.6% vs 6.7%;雙側(cè)p<0.001)�。
——在腺癌群體(AC)中:(1)死亡風(fēng)險降低44%,Libtayo治療組(n=65)中位生存期為13.3個月��、化療組(n=66)為7.0個月����,數(shù)據(jù)具有統(tǒng)計學(xué)顯著差異(HR=0.56��;95%CI:0.36-0.85)��。(2)疾病進展風(fēng)險降低9%(HR=0.91�����;95%CI:0.62-1.34)�����。(3)ORR提高(12% vs 4%)���。
——健康狀況/生活質(zhì)量:Libtayo治療的患者隨著時間的推移,總體上能夠改善或維持其基線的整體健康狀況/生活質(zhì)量(GHS/QOL)�����,而那些接受化療的患者則經(jīng)歷了從第8周期開始具有臨床意義的惡化�,根據(jù)EORTC QLQ-C30(總體估計平均變化95%CI:Libtayo改善1.0[95%CI:-2.0,4.0]���,化療惡化-6.8[95%CI:-11.0�,-2.6];差值=7.8)����。
——該試驗中,沒有觀察到Libtayo新的安全信號�。Libtayo治療組有88.3%的患者、化療組有91.4%的患者出現(xiàn)不良事件���,分別有29.7%���、26.9%的患者出現(xiàn)嚴(yán)重不良事件。
宮頸癌是全世界女性癌癥死亡的第四大原因���,常見的診斷年齡在35-44歲之間���。據(jù)估計�����,全世界每年約有60萬女性被診斷患有宮頸癌�,每年死亡超過35萬例。幾乎所有的病例都是由人乳頭瘤病毒(HPV)感染引起的�����,大約80%被歸類為鱗狀細(xì)胞癌(起源于宮頸底部的細(xì)胞),其余大部分是腺癌(起源于宮頸上部的腺細(xì)胞)���。子宮頸癌在早期發(fā)現(xiàn)和有效治療時通常是可以治愈的��,但晚期的治療選擇更為有限�。
Libtayo屬于PD-(L)1抑制劑�,這是當(dāng)前備受矚目的一類腫瘤免疫療法,旨在利用人體自身的免疫系統(tǒng)抵御癌癥���,通過阻斷PD-1/PD-L1信號通路使癌細(xì)胞死亡�����,具有治療多種類型腫瘤的潛力�。Libtayo是一種全人單抗��,靶向T細(xì)胞上的免疫檢查點受體PD-1�。通過與PD-1結(jié)合,Libtayo已被證明可以阻止癌細(xì)胞通過PD-1途徑抑制T細(xì)胞的活化�����。
此前,Libtayo已被批準(zhǔn)用于治療2種常見的皮膚癌晚期患者:(1)Libtayo是一個獲批治療晚期皮膚鱗狀細(xì)胞(CSCC)的藥物�����,適用于治療轉(zhuǎn)移性CSCC患者以及不適合根治性手術(shù)或根治性放療的局部晚期CSCC患者�;(2)Libtayo是一個獲批治療晚期基底細(xì)胞癌(BCC)的免疫療法,該藥適用于治療先前已接受過一種hedgehog通路抑制劑(HHI)治療或不適合該類藥物治療的晚期BCC患者�����。
2021年2月����,Libtayo獲得美國FDA批準(zhǔn)第3個適應(yīng)癥:用于一線治療腫瘤高表達PD-L1(腫瘤比例得分[TPS]≥50%)的晚期非小細(xì)胞肺癌(NSCLC)患者,具體為:腫瘤高表達PD-L1(TPS≥50%)�����、有轉(zhuǎn)移性或局部晚期腫瘤�����、不適合手術(shù)切除或根治性放化療�����、腫瘤無EGFR��、ALK或ROS1畸變的NSCLC患者�。
Libtayo采用再生元專利化的Velocimmune技術(shù)平臺創(chuàng)造并優(yōu)化,目前正被開發(fā)用于多種類型癌癥的治療���。Libtayo的廣泛臨床項目集中在難治癌癥上���,包括皮膚癌、宮頸癌��、實體瘤和血液癌癥�。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán),請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com