要說腫瘤組織中的大冤種��,非巨噬細胞莫屬�!
腫瘤微環(huán)境(TME)作為一個穩(wěn)定的微型生態(tài)體系�,是腫瘤細胞快樂繁殖的“伊甸園”,但對于巨噬細胞來說�����,無疑是塊連呼吸都費勁的“鹽堿地”��。巨噬細胞表示很委屈:“我不是真正的妥協(xié)�����,墻頭草只是我求生存的保護色��?����!?/span>
物競天擇�����,適者生存����。從腫瘤-免疫協(xié)同進化的角度來看,免疫細胞的確需要采取一些靈活走位來對抗嚴酷的TME�,同時可能也會被賦予免疫抑制特性,例如瘤內(nèi)高鉀(K+)對腫瘤浸潤T細胞的免疫抑制作用[1-2]�。
受限于營養(yǎng)缺乏的TME,不同的細胞群會根據(jù)自身需求優(yōu)先選擇特定的代謝物維系生存�����,這種細胞特異性的營養(yǎng)偏好在驅(qū)動免疫細胞特定表型方面起著關(guān)鍵作用[3-4]���。
盡管研究已經(jīng)證實����,在營養(yǎng)缺乏的TME中,腫瘤相關(guān)巨噬細胞(TAMs)的功能狀態(tài)受到了極大影響[5-6]�,然而,TAMs代謝重編程與其對外源營養(yǎng)物質(zhì)偏好之間的內(nèi)在聯(lián)系尚未闡明���。
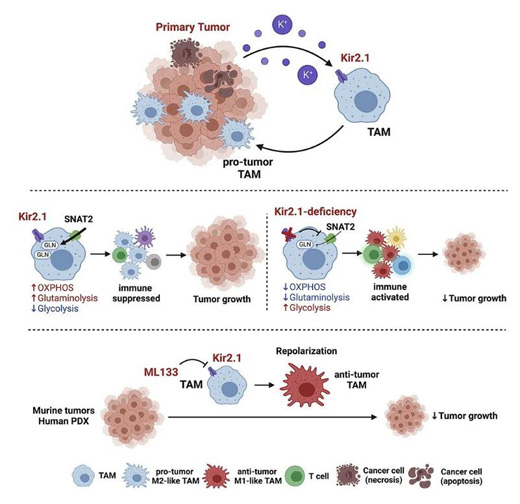
針對此問題�����,浙江大學(xué)醫(yī)學(xué)院丁克峰和王迪團隊進行了系統(tǒng)研究�����,并作為共同通訊在《細胞·代謝》雜志上發(fā)表了研究成果���。他們發(fā)現(xiàn),瘤內(nèi)高K+可通過內(nèi)向整流的K+通道(Kir2.1)塑造TAMs表型���,調(diào)控其功能極化,并顯著抑制其抗腫瘤能力(M2型)[7]�。
論文首頁截圖
該研究指出,Kir2.1是腫瘤調(diào)控TAMs功能極化的重要樞紐�,對TAMs電化學(xué)依賴的營養(yǎng)攝取至關(guān)重要?�;蚯贸蛩幚碜钄郖ir2.1會干擾TAMs對谷氨酰胺(GLN)的攝取,導(dǎo)致TAMs代謝重編程�����,由氧化磷酸化為優(yōu)勢的代謝特征轉(zhuǎn)化為糖酵解模式���,使TAMs復(fù)極化至抗腫瘤狀態(tài)(M1型)�,進而增強局部抗腫瘤免疫反應(yīng)����,顯著抑制腫瘤進展。
瘤內(nèi)高K+通過Kir2.1塑造TAMs代謝表型和功能狀態(tài)的模式圖
研究人員分析人結(jié)直腸癌(CRC)的腫瘤間質(zhì)液(TIF)和TAMs表型發(fā)現(xiàn)�����,瘤內(nèi)間質(zhì)K+水平與M1型TAMs顯著減少相關(guān)���。體外TAMs誘導(dǎo)實驗也證實�����,細胞外高K+會促進骨髓源性巨噬細胞(BMDMs)向促腫瘤狀態(tài)的M2型TAMs表型極化�。
為進一步探究高K+誘導(dǎo)TAMs功能極化的機制�����,研究人員對其進行了基因富集分析,結(jié)果顯示��,高K+抑制了一系列炎癥相關(guān)基因集�,而提高了氧化磷酸化、血管生成和免疫抑制細胞因子產(chǎn)生的基因集���,這表明瘤內(nèi)高K+對TAMs抗腫瘤表型的抑制�����,可能與其代謝特征改變相關(guān)��。
經(jīng)常規(guī)培養(yǎng)液和高K+培養(yǎng)液處理后巨噬細胞轉(zhuǎn)錄組的基因富集分析
沒有艱難的生存環(huán)境�,只有勇敢的巨噬細胞�!在瘤內(nèi)高K+的大環(huán)境下,巨噬細胞只能改造自身代謝來適應(yīng)TME����。但是,對于巨噬細胞上感應(yīng)高K+并驅(qū)動TAMs功能極化的“哨兵”�,我們依然無從得知�����。
于是,研究人員利用RNA高通量測序和膜片鉗技術(shù)�,終鎖定了內(nèi)向整流K+通道Kir2.1。電生理數(shù)據(jù)顯示�,巨噬細胞上存在功能性Kir2.1,可被高K+電流激活�,促進巨噬細胞向M2型TAMs極化。
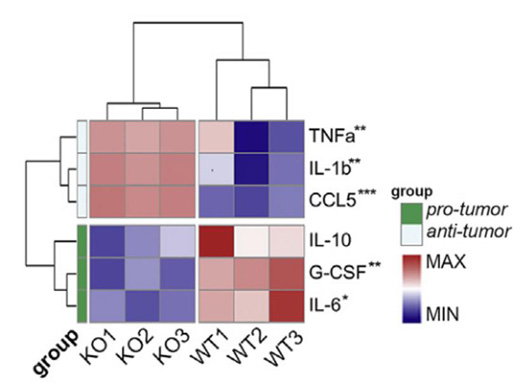
基因敲除編碼Kir2.1的基因Kcnj2后��,M2型TAMs水平降低�,且抗腫瘤細胞因子和生長因子分泌增加。這些數(shù)據(jù)表明�,Kir2.1是高K+條件下TAMs極化的重要調(diào)節(jié)因子,基因敲除或藥理阻斷Kir2.1會導(dǎo)致TAMs復(fù)極化趨向抗腫瘤狀態(tài)分化�。
野生型(Kcnj2f/f)與Kcnj2敲除(Kcnj2CKO)TAMs分泌細胞因子的熱圖
接下來,研究人員建立了多種移植瘤模型���,以探究TAMs表達Kir2.1在抗腫瘤免疫中的潛在作用��。結(jié)果顯示�����,敲除Kcnj2顯著抑制了移植瘤的生長�����,解除了高K+對TAMs抗腫瘤作用的抑制����,促使TAMs復(fù)極化為抗腫瘤的M1型,并明顯增強了局部抗腫瘤免疫效應(yīng)(TAMs吞噬凋亡腫瘤細胞能力下降����;瘤內(nèi)cGAMP、IFNγ和TNF-a水平增加����;CD4+Treg細胞減少)。
以上結(jié)果表明��,在離子紊亂的TME內(nèi)���,Kir2.1作為TAMs上感應(yīng)高K+的“哨兵”����,在TAMs促腫瘤表型極化中發(fā)揮了重要作用�����,而特異性阻斷Kir2.1不僅使TAMs復(fù)極化恢復(fù)到抗腫瘤狀態(tài),而且增強了局部抗腫瘤免疫效應(yīng)����。
繞了一大圈�,終于弄清楚了感知高K+并驅(qū)動TAMs極化的重要調(diào)控因子,那么問題來了����,TAMs是如何一步步調(diào)整代謝模式來適應(yīng)高K+環(huán)境的?
研究人員進一步分析發(fā)現(xiàn)�,敲除Kcnj2的TAMs,其優(yōu)勢代謝模式從氧化磷酸化轉(zhuǎn)向了糖酵解�����。此外��,Kcnj2CKO TAMs比Kcnj2f/f TAMs具有更高的膜電位��,但GLN和脂肪酸攝取卻明顯下降�,這表明Kir2.1調(diào)節(jié)的膜電位對TAMs攝取GLN至關(guān)重要,可能決定了TAMs水解GLN的代謝偏好�,進而影響TAMs極化狀態(tài)。
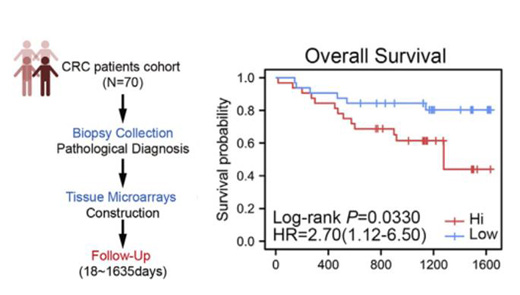
為進一步探索Kir2.1與腫瘤預(yù)后的關(guān)聯(lián)性��,研究人員對70例CRC患者進行了單中心回顧性隊列研究。他們發(fā)現(xiàn)早期CRC患者TAMs上Kir2.1表達強度低于晚期患者���,并且高表達Kir2.1的TAMs浸潤與患者預(yù)后不良有關(guān)����,這表明Kir2.1在TAMs上的表達強度與人類癌癥進展和臨床預(yù)后存在關(guān)聯(lián)性�����。
單中心回顧性隊列建立示意圖及患者的生存曲線
終末���,研究人員利用Kir2.1的選擇性抑制劑ML133��,對靶向Kir2.1的抗腫瘤治療潛力進行了評估�。
在CCR患者來源的類器官(PDO)中��,ML133治療極大增加了TAMs向M1型復(fù)極化的比例���,而且���,在PDO建立的異種移植瘤模型中,ML133與抗PD-1單抗聯(lián)合可顯著抑制腫瘤生長,具有更好的治療效果���,證實ML133靶向Kir2.1可能是一種調(diào)節(jié)TAMs復(fù)極化恢復(fù)抗腫瘤作用的潛在策略���。
總的來說,這項研究證實Kir2.1是TAMs代謝編程和功能極化的重要調(diào)控因子����,系統(tǒng)地描述了TME中離子紊亂對免疫細胞和其他成分的影響�,揭示了代謝模式和表型狀態(tài)之間的內(nèi)部聯(lián)系,為闡明TAMs功能極化以適應(yīng)TME的基本機制��,以及開發(fā)TAMs靶向免疫療法提供新的見解���。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標記有誤�,或侵犯您的版權(quán),請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com