美國時間12月22日��,羅氏(Roche)旗下基因泰克(Genentech)宣布�,美國FDA已批準Lunsumio(mosunetuzumab-axgb)用于治療經過兩種或多種前期系統治療后復發(fā)或難治的濾泡性淋巴瘤(FL)成年患者。根據基因泰克新聞稿�����,Lunsumio是一款CD20/CD3 T細胞銜接雙特異性抗體��,代表著一種無化療��、現貨型(off-the-shelf)新免疫治療選擇����。
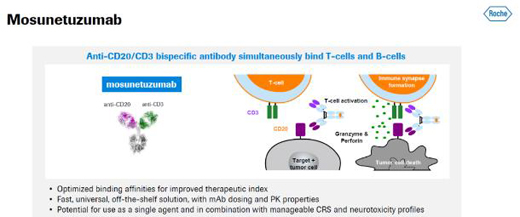
公開資料顯示,Lunsumio是一款靶向B細胞表面的CD20抗原和T細胞表面的CD3受體的T細胞銜接雙特異性抗體�。它可以引導患者體內的T細胞遷移到目標B細胞附近����,并且釋放細胞毒性的蛋白消滅B細胞��。Lunsumio以靜脈輸注的形式給藥���,持續(xù)時間固定��,允許休息治療����,也可以在門診輸液�。此前,該藥還曾獲FDA授予突破性療法認定和孤兒藥資格���。今年6月����,該藥在歐盟獲批��,用于治療復發(fā)/難治性濾泡性淋巴瘤成人患者�����,他們已經接受過至少兩種前期系統治療。
Mosunetuzumab的作用機制(圖片來源:羅氏官網)
此次FDA的批準是基于2期GO29781研究的積極結果�����,該試驗結果顯示出Lunsumio對于復發(fā)或難治濾泡性淋巴瘤患者具有較高且持久的應答率��。在接受Lunsumio治療的患者中���,80%的患者出現了客觀反應(包括完全反應和部分反應),大多數患者至少18個月內保持了反應(57%)����。應答者的中位應答持續(xù)時間接近2年。60%的患者獲得完全反應(CR)�����。在218名接受推薦劑量Lunsumio治療的血液系統惡性腫瘤患者中���,常見的不良事件(AE)是細胞因子釋放綜合征(CRS�����;39%)���,CRS事件的中位持續(xù)時間為3天�。其他常見AE包括疲勞�、皮疹、發(fā)熱和頭痛���。
Lunsumio試驗研究者Elizabeth Budde博士表示�,這一批準對復發(fā)或難治性濾泡性淋巴瘤患者來說是一個重要的里程碑��,他們迄今為止的治療選擇有限�����。作為一種可在門診環(huán)境中啟動的T細胞結合雙特異性抗體�����,Lunsumio的高應答率和固定持續(xù)時間可能會改變晚期濾泡性淋巴瘤的治療方式��。
白血病和淋巴瘤協會(LLS)首席科學官Lee Greenberger博士表示:“對于那些對多種治療方案沒有反應的血液癌患者來說����,這一新增的治療方案是一個好消息,因為血癌每次復發(fā)都會變得更難治療。這種雙特異性抗體是一種現成的���、可獲得的治療選擇��,有可能幫助復發(fā)或難治性濾泡淋巴瘤患者獲得緩解�?�!?/span>
聲明:本文版權歸原作者所有��,轉載文章僅為傳播更多信息���,如作者信息標記有誤,或侵犯您的版權���,請聯系我們���,我們將在及時修改或刪除內容,聯系郵箱:marketing@360worldcare.com