2月27日,SpringWorks Therapeutics宣布其γ-分泌酶抑制劑nirogacestat用于治療成人硬纖維瘤的新藥申請(qǐng)(NDA)已獲FDA優(yōu)先審評(píng)�����。處方藥使用者費(fèi)用法案(PDUFA)日期定為2023年8月27日�。此外,SpringWorks表示FDA目前不打算召開咨詢委員會(huì)會(huì)議來討論該NDA��。
硬纖維瘤是一種罕見的侵襲性���、局部浸潤(rùn)性�����、高復(fù)發(fā)性軟組織腫瘤��,常見于20至44歲人群�,尤其是女性�。此前,硬纖維瘤主要通過手術(shù)切除治療����,但手術(shù)后復(fù)發(fā)率高����。目前尚無相關(guān)療法獲批上市����。
nirogacestat是輝瑞開發(fā)的一種口服、選擇性����、小分子γ-分泌酶抑制劑。2017年9月���,輝瑞孵化的SpringWorks完成A輪融資并從輝瑞手中獲得4款臨床在研產(chǎn)品(nirogacestat��、mirdametinib���、Senicapoc和PF-0445784)的權(quán)益。
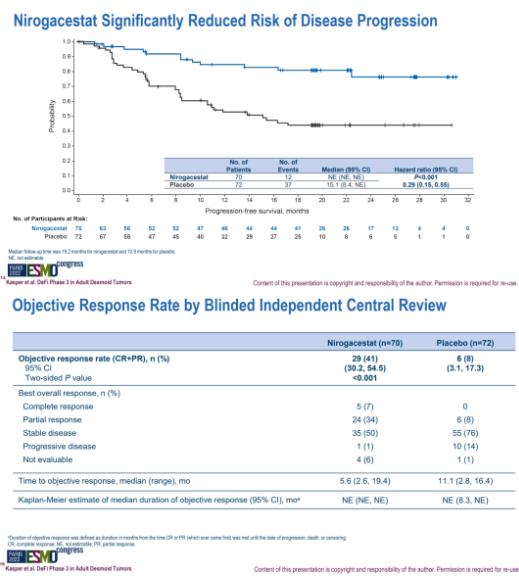
此次優(yōu)先審評(píng)主要是基于III期DeFi研究的積極結(jié)果�����。DeFi是一項(xiàng)全球性��、多中心����、隨機(jī)、雙盲�、安慰劑對(duì)照的臨床試驗(yàn),共納入142例患者�����,旨在評(píng)估nirogacestat(150mg�����,每日2次)對(duì)比安慰劑治療進(jìn)展性硬纖維瘤或侵襲性纖維瘤成年患者的有效性和安全性��。研究的主要終點(diǎn)為無進(jìn)展生存期(PFS)�����。
結(jié)果顯示�,nirogacestat組患者的PFS顯著延長(zhǎng)(無法估計(jì) vs 15.1個(gè)月;HR=0.29���;P<0.001)��。此外���,nirogacestat組患者的客觀緩解率顯著改善(41% vs 8%�;P<0.001)����。
Defi研究結(jié)果(來源:ESMO 2022)
SpringWorks首席執(zhí)行官Saqib Islam說:“硬纖維瘤患者可能會(huì)經(jīng)歷嚴(yán)重的疼痛和其他使人衰弱的疾病,我們很高興有機(jī)會(huì)改變這些患者的護(hù)理標(biāo)準(zhǔn)���。此次nirogacestat的NDA獲得優(yōu)先審評(píng)代表了我們?yōu)橛怖w維瘤患者提供一個(gè)批準(zhǔn)療法的雄心壯志的一個(gè)重要里程碑�。我們期待與FDA在審評(píng)過程中密切合作�����,并繼續(xù)專注于確保我們能夠在批準(zhǔn)后迅速為硬纖維瘤患者和醫(yī)生提供藥品��?��!?/span>
聲明:本文版權(quán)歸原作者所有��,轉(zhuǎn)載文章僅為傳播更多信息����,如作者信息標(biāo)記有誤���,或侵犯您的版權(quán)�����,請(qǐng)聯(lián)系我們��,我們將在及時(shí)修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com