2月28日��,再生元和賽諾菲聯(lián)合宣布����,F(xiàn)DA已經(jīng)批準(zhǔn)sarilumab(商品名:Kevzara)治療對(duì)皮質(zhì)類固醇(CS)反應(yīng)不佳或無法耐受皮質(zhì)類固醇減量的風(fēng)濕性多肌痛成年患者的上市申請���。這是一款獲FDA批準(zhǔn)治療該疾病的生物制劑���。
FDA此次的批準(zhǔn)主要基于sarilumab治療風(fēng)濕性多肌痛的一項(xiàng)III期臨床SAPHYR研究結(jié)果���。該試驗(yàn)共納入118名受試者���,隨機(jī)分成兩組,分別接受sarilumab 200mg+14周CS減量(n=60)和安慰劑+52周CS減量(n=58)治療�����。
結(jié)果顯示���,第52周時(shí)����,該試驗(yàn)達(dá)到了主要終點(diǎn)��,sarilumab組比安慰劑組有更多受試者實(shí)現(xiàn)了持續(xù)緩解(28% vs 10%�����,p=0.0193)����。持續(xù)緩解定義為第12周疾病緩解,無疾病爆發(fā)�,從第12到52周c反應(yīng)蛋白(CRP)正常,并在第12至52周堅(jiān)持CS減量方案��。
在將CRP排除在持續(xù)緩解定義之外的敏感性分析中同樣看到了這種顯著性差異,sarilumab組和安慰劑組患者持續(xù)緩解的比例分別為32%和14%��。次要終點(diǎn)方面�,兩組CS累積量中位數(shù)分別為2044 mg vs 777 mg。
治療期間�����,sarilumab組發(fā)生的常見不良事件有中性粒細(xì)胞減少癥(15%)����、白細(xì)胞減少癥(7%)、便秘(7%)等����,而安慰劑未發(fā)生此類不良反應(yīng)。
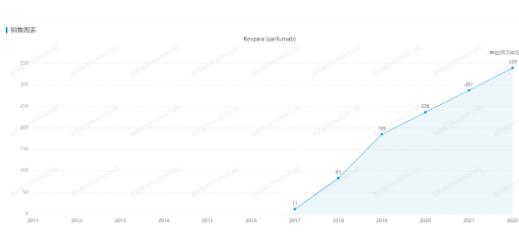
Sarilumab是一款直接靶向白介素-6(IL-6)受體的全人源化單克隆抗體���,由再生元與賽諾菲合作研發(fā)��,2017年首次獲FDA批準(zhǔn)上市�,用于治療類風(fēng)濕關(guān)節(jié)炎患者����。據(jù)悉,該產(chǎn)品2022年銷售額為3.39億歐元���。
Kevzara歷年銷售額(來源:醫(yī)藥魔方NextPharma數(shù)據(jù)庫)
風(fēng)濕性多肌病是一種可導(dǎo)致肩部����、頸部和髖部僵硬和疼痛的炎癥風(fēng)濕性疾病�����,常發(fā)生于50歲以上的中老年人��,并且以女性較為多見�����。最常見的癥狀是肩和骨盆束帶的疼痛和晨僵����,還可能會(huì)出現(xiàn)疲勞、發(fā)燒和體重減輕等一般癥狀�。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤,或侵犯您的版權(quán)�����,請聯(lián)系我們����,我們將在及時(shí)修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com