常見的小兒腦腫瘤����,迎來靶向聯(lián)合療法
膠質(zhì)瘤是起源于神經(jīng)上皮組織的惡性腫瘤,是常見的顱內(nèi)原發(fā)腫瘤�。按惡性程度,膠質(zhì)瘤可分為4級(jí)�,1-2級(jí)為低級(jí)別膠質(zhì)瘤。
低級(jí)別膠質(zhì)瘤(LGG)是常見的小兒腦腫瘤����。
BRAF V600突變存在于15-20%的兒童LGG中����,它與不良的生存結(jié)果和對(duì)化療的不良反應(yīng)有關(guān)。
BRAF突變已被確定為多種實(shí)體腫瘤中癌癥生長(zhǎng)的驅(qū)動(dòng)因素�,并且,患者的治療選擇非常有限���。
近日�,美國(guó)FDA已批準(zhǔn)Tafinlar+Mekinist聯(lián)合療法上市(含液體制劑)�����,用于治療1歲及以上患有BRAF V600E突變且需要全身治療的低級(jí)別膠質(zhì)瘤(LGG)患者。
Tafinlar+Mekinist的組合有助于通過阻斷與各種類型癌癥生長(zhǎng)相關(guān)的BRAF和MEK激酶相關(guān)的信號(hào)來減緩腫瘤生長(zhǎng)���。
Tafinlar+Mekinist聯(lián)合療法已被FDA批準(zhǔn)用于多種BRAF V600實(shí)體腫瘤治療����,包括黑色素瘤���、甲狀腺癌和肺癌等�����。
本次批準(zhǔn)是基于一項(xiàng)2/3期TADPOLE試驗(yàn)的積極結(jié)果���。
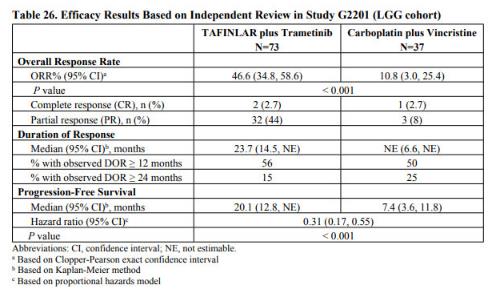
中位隨訪18.9個(gè)月,該試驗(yàn)數(shù)據(jù)顯示:
1���、Tafinlar+Mekinist組患者總體緩解率(ORR)為46.6%��,化療組患者的ORR為10.8%����。
2�、Tafinlar+Mekinist組中位無進(jìn)展生存期(PFS)為20.1個(gè)月,化療組為7.4個(gè)月。
3���、試驗(yàn)中觀察到的Tafinlar+Mekinist的安全性與其他已批準(zhǔn)適應(yīng)癥的安全性一致�。
“ 這一靶向聯(lián)合療法成為一個(gè)獲批用于治療BRAF V600E LGG兒童患者的聯(lián)合靶向療法��,它將成為一種新的標(biāo)準(zhǔn)治療選擇�。”
聲明:本文版權(quán)歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤���,或侵犯您的版權(quán)�����,請(qǐng)聯(lián)系我們,我們將在及時(shí)修改或刪除內(nèi)容�����,聯(lián)系郵箱:marketing@360worldcare.com