精神分裂癥新藥KarXT又一項III期成功��,再鼎擁有中國權益
3月20日���,Karuna Therapeutics宣布在研KarXT (xanomine -trospium)療法用于治療成人精神分裂癥的III期EMERGENT-3研究達到了主要終點�。
KarXT由xanomeline(M1/M4偏好毒蕈堿乙酰膽堿受體激動劑)和trospium(非CNS滲透性、非選擇性毒蕈堿拮抗劑)組成�����,后者可降低前者的毒副作用�����,從而將療效和安全性控制為較佳。
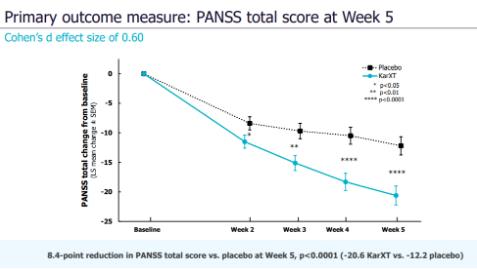
EMERGENT-3研究是一項為期5周��、雙盲�����、隨機��、安慰劑對照的III期臨床�����,旨在評估KarXT在精神分裂癥患者中的有效性���、安全性和耐受性���。結果顯示����,該研究達到了預設的主要終點,即與安慰劑相比�����,KarXT在陽性和陰性綜合征量表(PANSS)總評分上降低了8.4分,具有統(tǒng)計學和臨床意義�����。與之前的試驗一致��,通過PANSS總分評估�����,從第2周到試驗結束���,KarXT治療均表現(xiàn)出早期和持續(xù)的有統(tǒng)計學意義的癥狀改善���。
同時,KarXT還在研究中的次要終點���,精神分裂癥的陽性癥狀和陰性癥狀均實現(xiàn)減少�,與安慰劑相比����,KarXT的PANSS陽性分量表具有3.5分的臨床意義和統(tǒng)計學上的顯著降低�����。雖然在第5周未達到統(tǒng)計學顯著性閾值����,但與安慰劑相比��,在第4周KarXT的PANSS陰性癥狀分量表和PANSS Marder陰性癥狀分量表顯示出統(tǒng)計學意義上的顯著降低�����。
此外�,KarXT耐受性良好,副作用與之前的試驗基本一致���。KarXT和安慰劑的總體治療出現(xiàn)不良事件(TEAE)率分別為70%和50%��。治療組與安慰劑組與TEAE相關的停藥率相似���,分別為7%(KarXT組)和6%(安慰劑組),與EMERENT-1和EMERENT-2研究一致�。
EMERGENT-3主要終點結果
Karuna將于2023年中期向FDA提交KarXT用于治療精神分裂癥的新藥上市申請����。該申請將基于EMERGENT-1�、EMERGENT-2及EMERGENT-3研究的療效和安全性數(shù)據(jù)���,以及來自正在進行的EMERGENT-4和EMERGENT-5研究的長期安全性數(shù)據(jù)��。如果順利獲批���,KarXT有望在2024商業(yè)化上市。
2021年11月��,再鼎醫(yī)藥與Karuna Therapeutics簽訂了獨家許可協(xié)議���。根據(jù)協(xié)議�����,再鼎擁有在大中華區(qū)(包括中國內地��、中國香港����、中國澳門和中國臺灣地區(qū))開發(fā)、生產和商業(yè)化KarXT的權益�。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息���,如作者信息標記有誤�,或侵犯您的版權�����,請聯(lián)系我們��,我們將在及時修改或刪除內容�,聯(lián)系郵箱:marketing@360worldcare.com