漸凍癥新藥����!一款靶向SOD1突變反義核苷酸療法獲批上市
4月25日���,渤健/lonis聯(lián)合宣布FDA已同意加速批準(zhǔn)反義寡核苷酸療法tofersen上市�����,用于治療超氧化物歧化酶1 (SOD1)突變所致的肌萎縮側(cè)索硬化(ALS)患者����。這是一款針對ALS的基因靶向療法�。該適應(yīng)癥完全批準(zhǔn)將取決于目前正在進(jìn)行的tofersen在癥狀前SOD1-ALS患者中的III期ATLAS研究。
ALS�,俗稱漸凍癥,是一種進(jìn)行性神經(jīng)退行性疾病���,臨床主要表現(xiàn)為進(jìn)行性發(fā)展的骨骼肌萎縮��、無力�����、肌束顫動�����,患者生存時間平均為3~5年��,常見的死因是呼吸衰竭�����。SOD1-ALS是ALS的一種罕見遺傳性形式�,僅占全球約16.8萬ALS病例的2%����,大多患者疾病進(jìn)展迅速,發(fā)病后生存期不超過3年���。
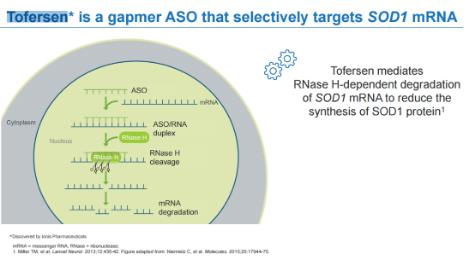
Tofersen由渤健與lonis共同開發(fā)��,是一種用于治療SOD1-ALS的反義寡核苷酸藥物����。Tofersen可與編碼SOD1的mRNA結(jié)合,使其被核糖核酸酶降解��,從而減少SOD1蛋白的產(chǎn)生�����。
2022年7月���,F(xiàn)DA受理該產(chǎn)品的上市申請并授予優(yōu)先審評資格��,將PDUFA日期定為2023年1月15日�����;同年10月��,渤健宣布FDA推遲了審批時間��,PDUFA延期3個月至2023年4月25日�。
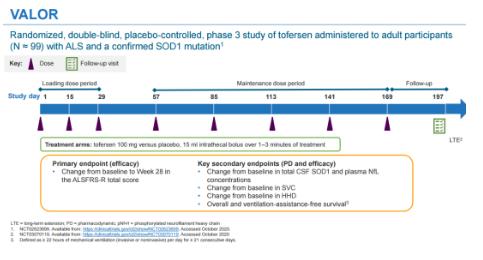
本次獲批上市主要是基于健康志愿者中的I期臨床試驗��、I/II期多劑量爬坡(MAD)臨床試驗����、III期臨床試驗VALOR以及開放標(biāo)簽擴(kuò)展 (OLE)的研究結(jié)果���,同時也包含了近12個月VALOR和OLE研究的整合結(jié)果。
此前所公布的關(guān)鍵III期VALOR研究并未達(dá)到主要終點���,進(jìn)展較快人群中修訂版肌萎縮側(cè)索硬化功能評定量表 (ALSFRS-R)評分從基線到第28周變化不具有顯著統(tǒng)計學(xué)差異(p=0.97)����。
然而�,該研究生物活性和臨床功能的多項次要和探索性終點分析顯示�,疾病進(jìn)展有減緩的趨勢。此外�����,近期公布的12個月整合性數(shù)據(jù)顯示�����,早期使用tofersen不僅能持續(xù)減少神經(jīng)絲輕鏈(NfL�,神經(jīng)元退行性變的一個潛在標(biāo)志)數(shù)目,還能減緩許多療效終點的下降��。
在此12個月的數(shù)據(jù)當(dāng)中,接受tofersen治療的患者常見的不良反應(yīng)為頭痛�����、操作性疼痛����、跌倒、背痛與肢體疼痛等�����。VALOR和OLE中的大多數(shù)AE嚴(yán)重程度為輕度至中度���。約有6.7%的患者出現(xiàn)嚴(yán)重的神經(jīng)性相關(guān)事件�����,包含脊髓炎��、神經(jīng)根炎���、無菌性腦膜炎與視神經(jīng)乳頭水腫。
神經(jīng)絲輕鏈蛋白(NfL)是一種存在于健康神經(jīng)元中���,當(dāng)神經(jīng)元或其軸突受損時���,大量NfL會釋放到血漿和腦脊液中��。大量研究表明�����,NfL是一種神經(jīng)退行性標(biāo)志物�,可作為神經(jīng)退行性疾病的替代終點��。
因此���,渤健利用NfL替代終點以尋求FDA加速批準(zhǔn)。此前3月���,F(xiàn)DA曾在專家咨詢委員會上提出幾點顧慮�,認(rèn)為NfL水平降低與ALFRS-R評分之間存在相關(guān)性�����,但變化幅度很?����。煌瑫r���,III期VALOR研究沒有提供臨床結(jié)果有利的證據(jù)���,無法評估是否可以通過生物標(biāo)志物預(yù)測ALS患者的疾病緩解情況。渤健表示��,確證性研究正在招募患者���,預(yù)計2027年獲得具體數(shù)據(jù)�。
截至目前�����,F(xiàn)DA已批準(zhǔn)4款治療ALS的藥物���,除了剛剛獲批的tofersen����,另外3款分別是上世紀(jì)90年代�、2017年以及2022年批準(zhǔn)的利魯唑��、依達(dá)拉奉和Relyvrio(苯丁酸鈉和?;撬岫伎诜潭▌┝颗浞?���,AMX0035),其中利魯唑和依達(dá)拉奉的效果比較差����,對患者生存和癥狀管理的影響不大。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤�����,或侵犯您的版權(quán),請聯(lián)系我們����,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com