阿伐替尼新適應(yīng)癥獲FDA批準(zhǔn)����,治療惰性系統(tǒng)性肥大細(xì)胞增多癥
5月22日����,Blueprint Medicines宣布,阿伐替尼(avapritinib)新適應(yīng)癥獲FDA批準(zhǔn)��,用于治療惰性系統(tǒng)性肥大細(xì)胞增多癥(ISM)��。
阿伐替尼是一款強效��、高選擇性�、口服針對肥大細(xì)胞/干細(xì)胞生長因子受體(c-Kit)和血小板衍生生長因子受體α(PDGFRA)突變的激酶抑制劑。
2018年6月���,基石藥業(yè)與Blueprint公司達(dá)成獨家合作和授權(quán)協(xié)議�,獲得了阿伐替尼在大中華地區(qū)(包括中國大陸��、中國香港�����、中國澳門和中國臺灣地區(qū))的獨家開發(fā)和商業(yè)化權(quán)利�。2021年3月,阿伐替尼在中國獲批上市��,商品名為泰吉華�����,用于治療攜帶PDGFRA外顯子18突變(包括PDGFRA D842V突變)的不可切除或轉(zhuǎn)移性胃腸道間質(zhì)瘤(GIST)成人患者��。
FDA此次批準(zhǔn)主要是基于全球性II期PIONEER研究的積極結(jié)果��。該研究是一項隨機����、雙盲、安慰劑對照的臨床試驗����,共納入212例患者,旨在評估阿伐替尼(25mg�����,每日1次)治療經(jīng)標(biāo)準(zhǔn)治療后癥狀控制不充分的ISM患者。研究的主要終點為第6個月ISM癥狀評估量表(ISM-SAF)評估的總癥狀評分(ASS)平均變化和II期推薦劑量(RP2D)����。
2023年3月,Blueprint在2023年美國過敏��、哮喘和免疫學(xué)會(AAAAI)年會上公布了該研究的積極結(jié)果�。
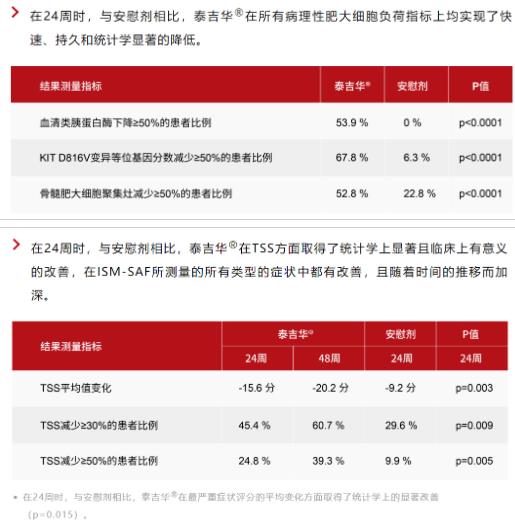
與此前報道的一致,阿伐替尼在主要和所有關(guān)鍵次要終點均具有統(tǒng)計學(xué)顯著性與臨床意義的重大改善����。更新的結(jié)果進(jìn)一步證實了阿伐替尼在病理性肥大細(xì)胞負(fù)荷、疾病癥狀——包括TSS����、嚴(yán)重的癥狀和所有類型癥狀,以及生活質(zhì)量方面均具有獲益����。阿伐替尼治療的患者在各個臨床指標(biāo)上均可見48周內(nèi)的改善持續(xù)加深。
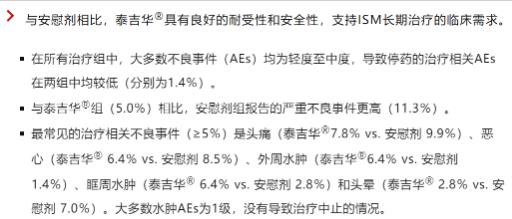
阿伐替尼耐受性良好�,安全性優(yōu)于安慰劑組,阿伐替尼治療的患者中96%選擇在開放標(biāo)簽擴展研究中繼續(xù)接受該治療��。
系統(tǒng)性肥大細(xì)胞增多癥(SM)是一種罕見的疾病,大約95%的病例是由KIT D816V突變引起的��。肥大細(xì)胞失控性的增殖和激活導(dǎo)致多器官系統(tǒng)出現(xiàn)各種慢性��、嚴(yán)重和突發(fā)癥狀�����。
大多數(shù)患者為患有非晚期(即惰性與冒煙型)SM���,其中絕大多數(shù)患者患有ISM。盡管既往曾采用多種藥物進(jìn)行對癥治療�,但通常療效有限,非晚期SM患者的各種癥狀��,包括過敏反應(yīng)����、斑丘疹、瘙癢�����、腹瀉�����、腦霧、疲勞和骨痛等����,仍持續(xù)存在。疾病負(fù)擔(dān)對患者的生活質(zhì)量產(chǎn)生嚴(yán)重的負(fù)面影響�。患者往往存在對嚴(yán)重���、突發(fā)癥狀的恐懼�����,工作能力或日?�;顒幽芰κ芟?,并不得不進(jìn)行自我隔離以避免不可預(yù)測的觸發(fā)因素�����。目前��,全球范圍內(nèi)尚無批準(zhǔn)的治療非晚期SM的療法�����。
少部分為晚期SM患者,有三個亞型���,包括ASM����、SM-AHN和MCL�。除了上述肥大細(xì)胞激活癥狀外����,晚期SM還與肥大細(xì)胞浸潤引起的多器官損傷和不良預(yù)后有關(guān)。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤�,或侵犯您的版權(quán),請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com