可恢復(fù)80%頭發(fā)生長��,這款藥獲FDA批準��,國內(nèi)已申報
美國當?shù)貢r間6月23日�����,輝瑞公司宣布�,美國食品和藥物管理局(FDA)已批準其雙激酶抑制劑Litfulo(ritlecitinib/利特昔替尼)上市���,推薦劑量為50毫克����。這是FDA批準的一個可用于患有嚴重斑禿的青少年(12+)的治療方法���。此前一年���,2022年6月���,F(xiàn)DA批準了禮來JAK抑制劑baricitinib(Olumiant/巴瑞替尼)口服片劑用于治療嚴重斑禿,不過適用人群為成年患者��。
兩款藥都為每日口服一次。
可恢復(fù)80%頭發(fā)生長
斑禿是全球發(fā)病率第二高的脫發(fā)癥�,世界上大約有1.47億斑禿患者,中國患者約有400萬�����。斑禿是一種自身免疫性疾病����,由于免疫系統(tǒng)攻擊毛囊,導(dǎo)致患者頭皮��、臉部或身體其他部分的毛發(fā)部分或完全脫落���,斑禿癥狀經(jīng)常在兒童時期就會發(fā)作,任何年齡�����、性別和種族的人群都可能患上斑禿�����。該疾病嚴重影響患者外在形象美觀,會對患者的心理健康和生活質(zhì)量產(chǎn)生負面影響�����。
Litfulo(ritlecitinib/利特昔替尼)是輝瑞開發(fā)的一款新型口服共價雙激酶抑制劑����,其對JAK3激酶以及在TEC家族中的酪氨酸激酶具有高度選擇性����,能夠抑制 IL-15 和 CD8 細胞因子信號轉(zhuǎn)導(dǎo)��,這兩個細胞因子是驅(qū)動免疫系統(tǒng)殺傷毛囊細胞的重要因素��。
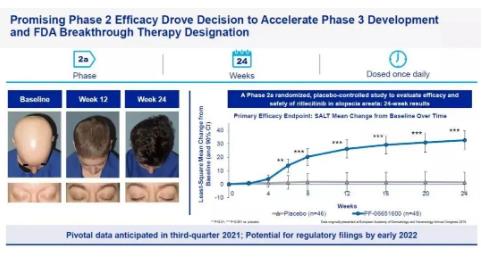
此次獲批基于Litfulo(ritlecitinib/利特昔替尼) 臨床2b/3期試驗ALLEGRO的研究���,該研究在18個國家和地區(qū)共118家研究中心評估Litfulo療效和安全性��。共入組718例斑禿患者����,這些患者至少有50%的頭發(fā)因斑禿而脫落�,研究結(jié)果顯示��,23%接受50mg Litfulo治療的患者在6個月后頭皮毛發(fā)覆蓋達80%或以上(SALT≤20)�����,而此數(shù)值在安慰劑組僅為1.6%,青少年(12-17歲)和成人(18歲及以上)使用Litfulo的療效和安全性一致����,同時,藥物安全性與耐藥性良好����,常見的不良反應(yīng)為頭痛、鼻咽炎與上呼吸道感染����。
國內(nèi)相關(guān)進展
醫(yī)谷查詢國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)信息顯示,2022年9月10日�,CDE受理了輝瑞Litfulo(ritlecitinib/利特昔替尼)的注冊申請。
不過��,禮來制藥的巴瑞替尼(商品名:艾樂明)同樣在國內(nèi)快其一步���。2023年3月27日���,禮來制藥宣布,其口服JAK抑制劑巴瑞替尼(商品名:艾樂明)獲得國家藥監(jiān)局批準��,用于成人重度斑禿的系統(tǒng)性治療,這也是國內(nèi)一個獲批用于系統(tǒng)性治療重度斑禿的創(chuàng)新靶向藥物���。
此外���,國內(nèi)還有多家企業(yè)正開展相關(guān)適應(yīng)癥的研究,恒瑞醫(yī)藥子公司瑞石生物的JAK1抑制劑SHR0302片和澤璟制藥的JAK1/2/3抑制劑杰克替尼都處在III期臨床研究階段�����,科倫博泰A223根據(jù)其新發(fā)布的港交所招股書顯示�����,該款在研藥品目前處于臨床II期�����。
值得一提的是�,Litfulo(ritlecitinib/利特昔替尼)除上述斑禿適應(yīng)癥外,2023年4月���,該款藥品還被納入國家藥監(jiān)局突破性治療品種,針對適應(yīng)癥為:適合系統(tǒng)性治療的非節(jié)段型白癜風患者(≥12歲)�����。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息�,如作者信息標記有誤,或侵犯您的版權(quán)���,請聯(lián)系我們�����,我們將在及時修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com