2023年7月6日��,美國耶魯大學JASON M. SHELTZER團隊在Science 在線發(fā)表題為“Oncogene-like addiction to aneuploidy in human cancers”的研究論文����,該研究報道了RedACT (使用CRISPR靶向恢復非整倍體細胞中的二倍體) ,這是一套染色體工程工具����,允許從癌癥基因組中消除特定的非整倍體。
使用ReDACT����,該研究創(chuàng)建了一組具有或缺乏常見非整倍體的同基因細胞,并且證明染色體1q 的三體對于攜帶這種改變的癌癥的惡性生長是必需的��。機制上講�����,獲得染色體1q會增加MDM4的表達并抑制p53信號傳導�����,并且該研究表明TP53突變在人類癌癥中與1q非整倍性相互排斥����。因此,腫瘤細胞可以依賴于特定的非整倍性����,這增加了這些“非整倍性依賴”可能作為治療策略的可能性。
染色體拷貝數變化�,也稱為非整倍性,是腫瘤基因組的普遍特征�����。雖然非整倍體在癌癥中的普遍性已經為人所知����,但非整倍體在腫瘤發(fā)展中的作用仍然存在爭議。染色體增益已被提出作為增加在改變區(qū)域內發(fā)現的腫瘤促進基因劑量的機制�,然而,這一假設的證據不足�,并且有替代性建議,非整倍性可能是由于在晚期惡性中經常發(fā)生的檢查點控制的喪失而引起的���。事實上�,由21號染色體三重引起的唐氏綜合癥患者患大多數實體癌的風險顯著降低��,這表明在某些情況下,非整倍體實際上可能具有腫瘤抑制特性���。
在過去的40年中����,癌癥研究人員已經使用分子遺傳學的標準工具�����,包括基因過表達��,敲低和誘變���,以發(fā)展對許多個體癌基因和腫瘤抑制因子的深刻理解��。例如����,KRAS和TP53等基因的生物學功能部分通過創(chuàng)建和分析表達或缺乏這些基因的同基因細胞系����。然而,現有的單基因操作方法不足以同時影響數百個基因的染色體尺度變化���。從人類癌細胞中消除特定非整倍體染色體的后果尚未確定�。
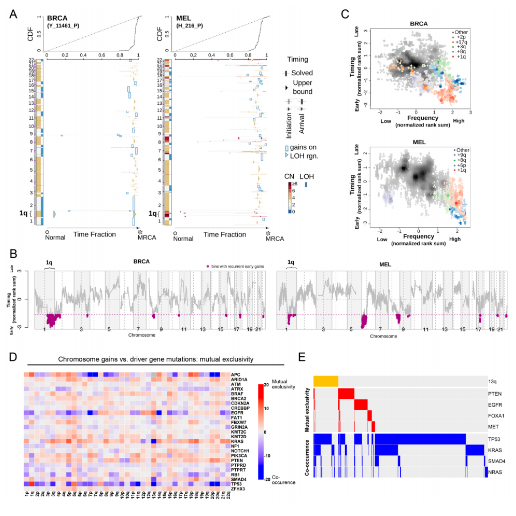
特定的染色體增益出現在腫瘤發(fā)展的早期,并且與驅動基因突變相互排斥(圖源:Science)
對單個癌癥驅動基因的研究導致發(fā)現了一種稱為“癌基因成癮”的現象����,其中單個癌基因的丟失或抑制足以誘導癌癥消退����。例如,KRAS突變導致胰腺癌的發(fā)展���,并且在“KRAS成癮”胰腺腫瘤中遺傳消融KRAS會阻止生長并觸發(fā)細胞凋亡���。以前的癌癥基因組測序項目已經揭示了在人類腫瘤中觀察到的非整倍性模式是非隨機的,并且像染色體1q和8q的增益這樣的特定事件比偶然預期的更頻繁地發(fā)生����。作者推測,這些復發(fā)性非整倍性本身可能代表一種癌癥“成癮”����,類似于癌基因成癮的概念。
該研究從已建立的癌細胞系中消除了內源性非整倍�。研究人員認為這些表型是專門由于非整倍體染色體的丟失���,而不是CRISPR選擇或消除目標染色體上編碼的點突變的副產品。該研究還證明了MDM4的單個額外拷貝足以抑制p53靶基因的表達并促進致癌生長����。該研究結果提出了一種令人興奮的可能性,即“非整倍性依賴”可能代表癌癥的治療脆弱性��。
聲明:本文版權歸原作者所有�,轉載文章僅為傳播更多信息,如作者信息標記有誤����,或侵犯您的版權,請聯(lián)系我們��,我們將在及時修改或刪除內容�����,聯(lián)系郵箱:marketing@360worldcare.com