雙管齊下增強(qiáng)疫苗效果��,華人學(xué)者引領(lǐng)mRNA技術(shù)新突破
將mRNA作為疫苗潛力巨大,但其先天免疫原性高��、易降解和體內(nèi)遞送效率低等問題���,導(dǎo)致其在疫苗開發(fā)中進(jìn)展不順。隨著 Drew Weissman 和 Katalin Karikó 提出的N1-甲基假尿苷(m1ψ)化學(xué)修飾��,以及脂質(zhì)納米顆粒(LNP)遞送載體的發(fā)明�,為mRNA疫苗的開發(fā)掃除了上述障礙。
mRNA新冠疫苗的成功���,讓我們看到了這種基于mRNA技術(shù)的新型疫苗平臺(tái)的強(qiáng)大威力��。以mRNA新冠疫苗為例�����,編碼了新冠病毒刺突蛋白(S蛋白)的經(jīng)過化學(xué)修飾的mRNA被封裝到了LNP中����,以保護(hù)mRNA不會(huì)被快速降解,并幫助其進(jìn)入細(xì)胞�。一旦進(jìn)入細(xì)胞中,其mRNA會(huì)被翻譯表達(dá)刺突蛋白���,被免疫系統(tǒng)檢測(cè)到��,從而產(chǎn)生中和抗體并激活T細(xì)胞免疫反應(yīng)���。如果此后感染新冠病毒,免疫系統(tǒng)會(huì)識(shí)別并迅速動(dòng)員��。
然而���,化學(xué)修飾的mRNA的耐受性和翻譯能力得到了提高���,但也在很大程度上損害了先天免疫反應(yīng)。因此�,全世界各地的科學(xué)家們正在努力改進(jìn),嘗試開發(fā)出更強(qiáng)大����、能夠產(chǎn)生更強(qiáng)的免疫反應(yīng)的mRNA疫苗。
2023年9月6日�,加拿大核酸疫苗與治療研究主任(Canada Research Chair)、多倫多大學(xué)藥學(xué)院助理教授李博文聯(lián)合麻省理工學(xué)院教授 Robert Langer�、Daniel Anderson在 Nature Biomedical Engineering 期刊發(fā)表了題為:Enhancing the immunogenicity of lipid-nanoparticle mRNA vaccines by adjuvanting the ionizable lipid and the mRNA(通過佐劑化可電離脂質(zhì)和mRNA來增強(qiáng)LNP-mRNA疫苗的免疫原性)的研究論文【1】。
該研究同時(shí)對(duì)mRNA本身及其遞送載體LNP進(jìn)行工程化改造�����,一次通過雙管齊下的方式開發(fā)出了“自佐劑化”mRNA疫苗����,該疫苗通過注射接種或鼻內(nèi)吸入式接種,均可大幅提高中和抗體滴度和T細(xì)胞應(yīng)答���。
如果進(jìn)一步將其應(yīng)用于人體���,這類新型mRNA疫苗所需的劑量更低,從而有助于降低成本����,并可能產(chǎn)生更持久的免疫力。該疫苗平臺(tái)也可能有助于增強(qiáng)包括腫瘤疫苗在內(nèi)的其他類型mRNA疫苗的免疫反應(yīng)��。
在這項(xiàng)發(fā)表于 Nature Biomedical Engineering 期刊的論文中���,李博文等人希望進(jìn)一步提高mRNA技術(shù)的潛力���,增強(qiáng)mRNA疫苗的免疫反應(yīng)��。
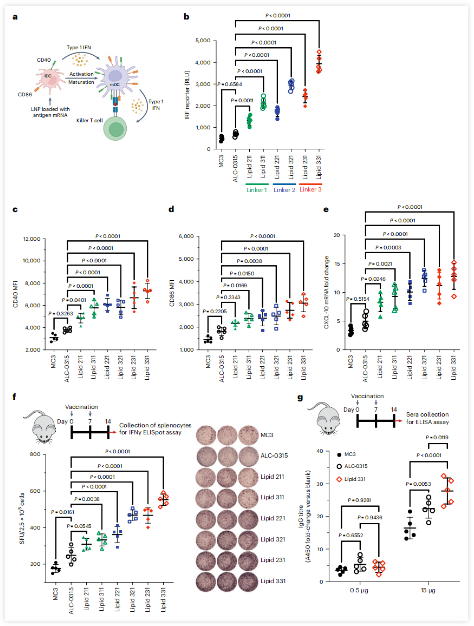
佐劑(Adjuvant)是一種常用于增強(qiáng)疫苗免疫應(yīng)答的分子���,但尚未應(yīng)用于mRNA疫苗。在這項(xiàng)研究中����,研究團(tuán)隊(duì)對(duì)mRNA本身及其遞送載體LNP同時(shí)進(jìn)行工程改造,從而一次通過雙管齊下的方式開發(fā)出“自佐劑性”的mRNA疫苗�����,讓疫苗的內(nèi)外成分同時(shí)發(fā)揮佐劑作用��,從而增強(qiáng)mRNA疫苗的免疫反應(yīng)����。
首先,他們將目光聚焦在了C3d蛋白上����,這是先天免疫系統(tǒng)的分支——補(bǔ)體系統(tǒng)的一部分,當(dāng)補(bǔ)體系統(tǒng)被外源微生物激活時(shí)��,補(bǔ)體中的C3d會(huì)附著到潛在抗原上,放大機(jī)體對(duì)這些抗原的產(chǎn)生的免疫反應(yīng)���。
在這種先天免疫機(jī)制的啟發(fā)下,研究團(tuán)隊(duì)構(gòu)建了編碼抗原(新冠病毒S蛋白的RBD結(jié)合域)和三個(gè)C3d的融合蛋白的mRNA��,這樣一來����,mRNA進(jìn)入細(xì)胞后就能夠表達(dá)出綜合這兩種功能的抗原-C3d融合蛋白。
李博文表示�����,在這項(xiàng)實(shí)驗(yàn)中�����,雖然添加C3d重復(fù)序列稍微降低了mRNA的蛋白表達(dá)量�����,但在相同的mRNA劑量下����,生成的抗原-C3d融合蛋白的免疫激活能力卻超過了原始抗原的10倍以上��。重要的是����,如果把抗原和C3d分開在兩條獨(dú)立的mRNA中表達(dá)��,就不會(huì)產(chǎn)生這種顯著的免疫增強(qiáng)效應(yīng)���。這一特異性意味著C3d不會(huì)盲目地增強(qiáng)其他抗原的免疫活性����, 從而確保了它應(yīng)用于疫苗增強(qiáng)上的安全性����。這個(gè)idea起初是受到自己研究生階段閱讀的一篇發(fā)表于1996年的 Science 論文的啟發(fā)。該論文顯示��,含有兩個(gè)和三個(gè)C3d的雞蛋溶菌酶的免疫原性分別是單獨(dú)雞蛋溶菌酶的1000倍和10000倍�����,而單獨(dú)游離的C3d對(duì)該抗原的免疫反應(yīng)沒有影響�����。mRNA技術(shù)讓我們能容易就可以實(shí)現(xiàn)抗原與C3d的融合,迅速在mRNA框架內(nèi)驗(yàn)證了這一論文的發(fā)現(xiàn)���,并將C3d當(dāng)做分子佐劑一次應(yīng)用到mRNA疫苗里����。
除了對(duì)mRNA分子層面的修改之外�,研究團(tuán)隊(duì)還嘗試優(yōu)化用于遞送mRNA疫苗的脂質(zhì)納米顆粒(LNP)��,從而讓LNP除了遞送mRNA外���,還能發(fā)揮刺激免疫反應(yīng)的作用�。
納米顆粒本身可能具有刺激免疫反應(yīng)作用�,但并不確定什么組分能夠優(yōu)化這種刺激作用。為了確定較有效的組分�����,研究團(tuán)隊(duì)構(gòu)建了一個(gè)包含480種具有不同化學(xué)性質(zhì)的可電離脂質(zhì)文庫�����,通過對(duì)這一文庫進(jìn)行高通量篩選和評(píng)估����,從中發(fā)現(xiàn)了一些可能提高免疫反應(yīng)的脂質(zhì)�。
接下來��,研究團(tuán)隊(duì)在小鼠模型中測(cè)試了基于上述發(fā)現(xiàn)的新型mRNA疫苗���,其mRNA編碼了S蛋白和C3d融合蛋白���,并使用了從文庫中篩選鑒定到的性能較好的可電離脂質(zhì)(lipid 331)組成的LNP遞送載體。
與接種無佐劑的新冠mRNA疫苗的小鼠相比�����,接種這種新型mRNA疫苗的小鼠產(chǎn)生的中和抗體水平提高了10多倍��,而且還產(chǎn)生了更強(qiáng)的T細(xì)胞反應(yīng)���。
今年6月份�����,賓夕法尼亞大學(xué)Michael J. Mitchell 教授團(tuán)隊(duì)(韓雪祥博士為第一作者)在 Nature Nanotechnology 期刊發(fā)表論文【2】�����,開發(fā)了一種新的LNP組分——佐劑類脂質(zhì)���,可以增強(qiáng)mRNA-LNP疫苗的佐劑性����。
李博文表示����,團(tuán)隊(duì)開發(fā)多重佐劑平臺(tái)的目的是克服單一佐劑類脂質(zhì)在劑量依賴性方面的局限,這一點(diǎn)在疫苗劑量較低時(shí)尤為明顯���。這并不難理解,因?yàn)楦叩囊呙鐒┝繒?huì)帶來更多的佐劑類脂質(zhì)以加強(qiáng)免疫激活����,反之則效果有限?����?紤]到疫情初期mRNA疫苗的供應(yīng)短缺���,我們希望通過極低的劑量下也能實(shí)現(xiàn)優(yōu)越或至少相似的疫苗效果���,而單一佐劑方案無法實(shí)現(xiàn)這一目標(biāo)�。因此�,我們構(gòu)建了這個(gè)具有多重佐劑性能的疫苗平臺(tái),即使在非常低的劑量下����,也能顯著增強(qiáng)疫苗的免疫效應(yīng),實(shí)現(xiàn)“1+1>2”的綜合效果�����。這種多重佐劑性mRNA-LNP疫苗設(shè)計(jì)不僅能通過降低劑量來減少成本和潛在的副作用��,還在某些特定應(yīng)用場(chǎng)景(如兒童疫苗或鼻腔疫苗)具有很高的價(jià)值��。
針對(duì)呼吸道黏膜的鼻內(nèi)疫苗可能解決肌肉內(nèi)接種的不足����。鼻內(nèi)流感疫苗的臨床前研究顯示,黏膜免疫可以通過IgA抗體和組織駐留T記憶細(xì)胞增強(qiáng)對(duì)不同亞型流感病毒的保護(hù)�����, 并提高抗病毒免疫力的持久性。此外�����,鼻內(nèi)疫苗對(duì)兒童和有針頭恐懼癥的人更容易接受�����,也能規(guī)避針頭和注射器或其他材料的短缺���。尤其在大流行期間���,使用鼻內(nèi)疫苗對(duì)整個(gè)人群進(jìn)行免疫將比肌肉內(nèi)注射更快、更具成本效益���。
李博文還提到,這項(xiàng)工作開始于新冠疫情初期���,當(dāng)時(shí)還不清楚mRNA疫苗是否可以進(jìn)行鼻腔內(nèi)接��,因?yàn)槠溆行钥赡軙?huì)受到覆蓋上呼吸道的黏液纖毛屏障的嚴(yán)重阻礙�。
考慮到鼻腔疫苗的潛在優(yōu)勢(shì)����, 團(tuán)隊(duì)進(jìn)一步探索了將這種新型RNA疫苗平臺(tái)進(jìn)行鼻腔內(nèi)接種的可行性����。當(dāng)將該疫苗注入小鼠鼻腔后��,他們?cè)谛∈笊砩嫌^察到了與注射注射接種類似的強(qiáng)烈免疫反應(yīng)�����。如果該疫苗被開發(fā)用于人體���,這種鼻內(nèi)吸入式疫苗可能會(huì)提供更強(qiáng)的保護(hù)作用�����,因?yàn)樗鼤?huì)在鼻腔和肺部的黏膜組織中產(chǎn)生免疫反應(yīng)����, 在傳染病毒進(jìn)入血液循環(huán)之前就在黏膜處將其消滅��。
論文通訊作者 Daniel Anderson 教授表示:如果你只是往鼻子里噴一些東西��,而不是排隊(duì)接種注射疫苗����,那么鼻內(nèi)疫苗可能也更容易讓多人接種���。
除了用于傳染病疫苗外,mRNA技術(shù)的另一個(gè)重要應(yīng)用是腫瘤疫苗�,據(jù)悉,研究團(tuán)隊(duì)正在進(jìn)行相應(yīng)探索��,還計(jì)劃在大動(dòng)物模型中測(cè)試這些新疫苗配方的有效性和安全性����,希望終能在人類患者上進(jìn)行測(cè)試。此外����,這種mRNA疫苗能夠在較低劑量下能引起更強(qiáng)的免疫反應(yīng),這也有助于減少接種所需的疫苗劑量�,從而降低成本,幫助疫苗覆蓋到更多的人群�,特別是在中低收入國(guó)家和地區(qū)。
李博文表示���,實(shí)驗(yàn)室正積極致力于將該疫苗增強(qiáng)平臺(tái)應(yīng)用于新抗原腫瘤疫苗的研發(fā)。眾所周知���,由于腫瘤引發(fā)的免疫抑制現(xiàn)象��,癌癥疫苗的研發(fā)難度相對(duì)傳染病疫苗來說更大�����, Curevac公司的CEO Ingmar Hoerr 在其前列腺癌mRNA疫苗進(jìn)入第二期臨床試驗(yàn)失敗后指出:What we’ve learned here is that mRNA is not enough on its own — you have to break tolerance and you have to make it more immunogenic (我們從這里學(xué)到的是���,單純的mRNA是不夠的——你需要打破免疫耐受��,并增強(qiáng)其免疫原性)���。如何在保證安全性的前提下有效地打破免疫抑制,增強(qiáng)癌癥疫苗引起特異性免疫反應(yīng)一直是研究界的關(guān)注焦點(diǎn)����。
博士后研究期間,李博文師從LNP技術(shù)先驅(qū)�����、麻省理工學(xué)院教授 Robert Langer(Moderna聯(lián)合創(chuàng)始人)和 Daniel Anderson(Orna Therapeutics聯(lián)合創(chuàng)始人)��,在此期間��,他開發(fā)了能夠高通量合成和篩選用于mRNA遞送的可電離脂質(zhì)組合文庫,在此基礎(chǔ)上發(fā)現(xiàn)了一系列新型LNP�,可將mRNA遞送到包括肝臟、脾臟和肺部等器官中���,還可將Cas9/sgRNA-mRNA遞送到肺上皮細(xì)胞����、免疫細(xì)胞以及肝臟細(xì)胞中�,實(shí)現(xiàn)長(zhǎng)期的基因編輯。此外�����,他還開發(fā)了一系列具有雙重功能的LNP��,不僅能夠遞送mRNA�,還可以作為佐劑來增強(qiáng)免疫反應(yīng)。這些工作可應(yīng)用于更好地幫助人類對(duì)抗傳染病��、癌癥�、自身免疫疾病,以及罕見遺傳疾病�。
2022年2月,李博文加入了多倫多大學(xué)藥學(xué)院,任助理教授�,并出任加拿大核酸疫苗與治療研究主任(Canada Research Chair)�,他的實(shí)驗(yàn)室致力于開發(fā)新型、安全有效的核酸遞送平臺(tái)���,開發(fā)基于核酸的新型疫苗和治療方法���,用于包括疫苗接種、免疫治療和再生醫(yī)學(xué)在內(nèi)的一系列人類健康應(yīng)用���。
眾所周知�,LNP會(huì)向肝臟富集�,因此,如何實(shí)現(xiàn)肝外靶向����,是將mRNA技術(shù)應(yīng)用于肝臟以外疾病治療中的一大挑戰(zhàn)。
今年3月份��,李博文�����、Robert Langer、Daniel Anderson 等在 Nature Biotechnology 期刊發(fā)表了題為:Combinatorial design of nanoparticles for pulmonary mRNA delivery and genome editing(用于肺部mRNA遞送和基因組編輯的納米顆粒的組合設(shè)計(jì))的研究論文【3】��。
該研究利用構(gòu)建的可電離脂質(zhì)組合文庫��,篩選并鑒定了吸入式遞送載體——RCB-4-8 LNP�,這種領(lǐng)先的LNP具有更好的生物可降解性和安全性,可重復(fù)氣管內(nèi)給藥��。它提供了全球一個(gè)成功利用LNP實(shí)現(xiàn)高效肺上皮細(xì)胞基因編輯的方法���,為先天性肺部疾病的基因治療開辟了新的途徑���。
該研究實(shí)現(xiàn)了LNP對(duì)對(duì)肺部的靶向,通過吸入式遞送�,成功在小鼠肺部細(xì)胞進(jìn)行CRISPR基因編輯,這為開發(fā)有效治療肺部疾病的基因編輯藥物奠定了基礎(chǔ)��。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán),請(qǐng)聯(lián)系我們,我們將在及時(shí)修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com