阿斯利康「依庫珠單抗」新適應(yīng)癥在華獲批
10月17日���,阿斯利康補體C5抑制劑依庫珠單抗的新適應(yīng)癥獲國家藥監(jiān)局批準,用于治療視神經(jīng)脊髓炎譜系障礙(NMOSD)�。
NMOSD是一種攻擊中樞神經(jīng)系統(tǒng)(CNS)的罕見破壞性疾病,其中由抗水通道蛋白-4(AQP4)抗體引起的補體激活在疾病過程中起重要作用����。NMOSD常見的癥狀是橫脊髓炎和視神經(jīng)炎,橫脊髓炎可導致包括癱瘓在內(nèi)的行動不便�,視神經(jīng)炎可導致失明等視覺問題。NMOSD患者會經(jīng)歷不可預(yù)測的復(fù)發(fā)����,可能對患者大腦和脊柱造成不可逆轉(zhuǎn)的損傷,并導致長期殘疾���。
依庫珠單抗(商品名:Soliris)是全球一款獲批的補體抑制劑����,通過抑制終端補體來抑制免疫系統(tǒng)的失控性激活�。依庫珠單抗早于2018年8月23日在國內(nèi)獲批上市,用于治療陣發(fā)性血紅蛋白尿(PNH)和非典型溶血性尿毒癥綜合征(aHUS)����,并于2023年6月2日獲批治療全身型重癥肌無力(gMG) 。
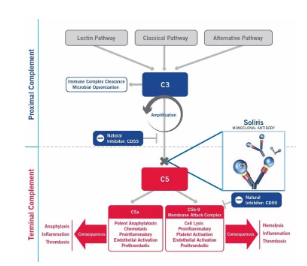
依庫珠單抗作用機制
一項代號為PREVENT的多國、雙盲����、平行對照III期臨床研究評估了Soliris用于治療自體抗AQP4抗體陽性NMOSD的有效性和安全性。試驗共納入了在過去12個月內(nèi)有至少兩次復(fù)發(fā)史或24個月內(nèi)有三次復(fù)發(fā)史�����,并在篩查前的12個月內(nèi)至少復(fù)發(fā)一次的143例成人患者�����,以2:1的比例被隨機分配至Soliris或安慰劑組接受治療�����。
結(jié)果顯示�,與安慰劑組相比,Soliris組患者的NMOSD復(fù)發(fā)風險降低了94.2%(p<0.0001)��。在48周時�,接受Soliris治療的患者中有97.9%沒有復(fù)發(fā),而安慰劑組這一數(shù)值為63.2%����。在關(guān)鍵的次要終點上�,與安慰劑相比���,Soliris治療將判定的年度復(fù)發(fā)率減少了95.5%(p<0.0001)�����。總體而言��,Soliris具有良好的耐受性����,其安全性與先前的臨床研究和其在其他已獲批適應(yīng)癥中的表現(xiàn)一致。
依庫珠單抗起初由Alexion開發(fā)�,2020年12月12日,阿斯利康以390億美元收購Alexion獲得了依庫珠單抗和Ravulizumab(商品名:Ultomiris)這兩款重磅補體C5抑制劑�����。根據(jù)阿斯利康財報�,2022年,Soliris和Ultomiris全球銷售額分別為37.62億美元和19.65億美元��。
阿斯利康在補體領(lǐng)域進行了全面布局�,除了Soliris和Ultomiris外�����,該公司first-in-class口服因子D(Factor D)抑制劑danicopan作為C5抑制劑的附加治療�,在治療PNH的III期研究中大獲成功(詳見:阿斯利康first-in-class口服PNH新藥III期研究成功�,已申報上市)。
此外�,阿斯利康的C5/albumin雙抗ALXN1720已進展至II期臨床階段。ALXN1720是第三代C5抑制劑�,是一種迷你雙抗(25kD),只包含了靶向C5的抗體重鏈可變區(qū)(VH)和與白蛋白(albumin)特異性結(jié)合的抗體片段�。較小的分子量可以帶來更好的滲透性,并且與白蛋白的結(jié)合能夠延長其半衰期���。ALXN1720有望成為一款可居家用藥的每周1次的皮下注射療法���。ALXN1720已完成針對全身型重癥肌無力(gMG)的II期研究,但未披露結(jié)果����。阿斯利康將在今年啟動ALXN1720治療gMG的III期研究。
聲明:本文版權(quán)歸原作者所有�����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤���,或侵犯您的版權(quán)�����,請聯(lián)系我們����,我們將在及時修改或刪除內(nèi)容����,聯(lián)系郵箱:marketing@360worldcare.com