復(fù)旦腫瘤醫(yī)院破解胰腺癌新輔助治療療效“秘訣”
胰腺癌是一種惡性程度極高的消化系統(tǒng)腫瘤,五年生存率僅約10%����,因而被稱為“癌中之王”。外科手術(shù)是胰腺癌的根治手段�,但整體手術(shù)療效尚不令人滿意。
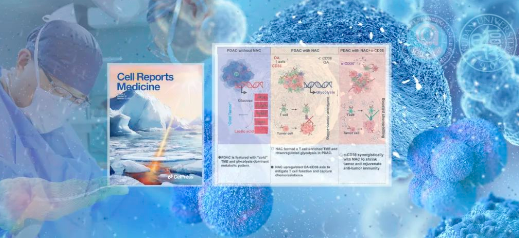
10月17日�����,復(fù)旦大學(xué)附屬腫瘤醫(yī)院胰腺外科虞先濬/施思團隊發(fā)表的一項研究成果破解了“癌王”新輔助治療療效的“秘訣”:胰腺癌患者在接受新輔助治療后��,胰腺癌出現(xiàn)了由“冷”變“熱”���、由“糖”轉(zhuǎn)“脂”的狀態(tài)改變��;此外��,靶向新輔助治療后上調(diào)的代謝免疫關(guān)鍵分子CD36(白細胞分化抗原36)��,可以顯著提升胰腺癌治療效果���。該項研究揭示了新輔助治療在胰腺癌微觀層面產(chǎn)生的作用和機制,證實靶向CD36可以顯著促進抗腫瘤免疫�����,并與標(biāo)準(zhǔn)新輔助治療方案產(chǎn)生協(xié)同作用抑制胰腺癌進展�。《細胞報道醫(yī)學(xué)》(Cell Reports Medicine)以封面文章的形式發(fā)表了這項重要研究成果��。
復(fù)旦大學(xué)附屬腫瘤醫(yī)院院長���、胰腺外科教授虞先濬表示�,近年來�,在胰腺癌手術(shù)前進行的抗腫瘤治療——即術(shù)前新輔助治療,在交界性可切除胰腺癌和具有高危因素的可切除胰腺癌的治療中得到了廣泛認同和應(yīng)用��。從治療效果來看�����,術(shù)前新輔助治療可以使胰腺腫瘤降期降級�,進一步提高手術(shù)根治性。然而���,從作用機制層面來看�,術(shù)前新輔助治療對胰腺癌帶來哪些改變,這些改變又對胰腺癌產(chǎn)生何種影響����,醫(yī)學(xué)界尚缺乏系統(tǒng)研究。
為闡明這一作用機制���,虞先濬/施思領(lǐng)銜團隊開展了系列研究���。團隊通過對經(jīng)/未經(jīng)白蛋白結(jié)合型紫杉醇聯(lián)合吉西他濱(AG)方案新輔助治療的胰腺癌組織進行蛋白-轉(zhuǎn)錄組測序以及生物信息學(xué)分析,發(fā)現(xiàn)新輔助治療后上調(diào)的基因與胰腺癌患者較長的總生存期相關(guān)�。這提示除了外科學(xué)獲益外,新輔助治療在微觀的分子生物學(xué)角度也能為患者帶來獲益����。
同時,通過對樣本進行分子分型���,發(fā)現(xiàn)新輔助治療后�����,胰腺癌由“冷”變“熱”���,即“免疫熱”的分子亞型比例顯著升高�����。單細胞空間轉(zhuǎn)錄組測序及組織化學(xué)染色結(jié)果也提示CD8+T細胞以及TCR克隆擴增在新輔助治療組中的比例上調(diào)��。
此外,結(jié)合代謝組學(xué)測序以及代謝流實驗的結(jié)果�,發(fā)現(xiàn)新輔助治療后胰腺癌的狀態(tài)由“糖”轉(zhuǎn)“脂”,即糖酵解水平顯著降低�,而脂肪酸受體CD36其配體油酸出現(xiàn)上調(diào)。
由此��,研究團隊認為CD36的上調(diào)可能是化療壓力下胰腺癌產(chǎn)生的一種代償性的代謝支流�����,為腫瘤細胞提供能量支持�����。如果阻斷這一支流���,有可能提高胰腺癌新輔助治療的療效����。進一步,研究團隊通過類器官模型及動物實驗證實了這一設(shè)想����,即靶向CD36可以顯著促進抗腫瘤免疫并與AG方案產(chǎn)生協(xié)同作用抑制胰腺癌進展。
復(fù)旦大學(xué)附屬腫瘤醫(yī)院胰腺外科副教授施思說�����,本研究揭示了胰腺癌新輔助治療療效的作用機制���,同時為胰腺癌的新輔助治療提供了AG聯(lián)合CD36單抗這一種全新策略。值得注意的是����,盡管本研究是基于新輔助治療后的發(fā)現(xiàn),但研究結(jié)論可以推廣到晚期轉(zhuǎn)移性胰腺癌等更多人群���。研究團隊未來將開展臨床試驗�,在不同分期的胰腺癌患者中驗證AG聯(lián)合CD36單抗方案的療效�。
復(fù)旦大學(xué)附屬腫瘤醫(yī)院胰腺外科唐榕、主任醫(yī)師徐近���、主任醫(yī)師王巍�����、主治醫(yī)師孟慶才為共同第一作者�����。虞先濬和施思為共同通訊作者����。中國胰腺癌多學(xué)科研究協(xié)作學(xué)組(CSPAC)��、海軍軍醫(yī)大學(xué)第二附屬醫(yī)院主任醫(yī)師邵成浩���、浙江大學(xué)醫(yī)學(xué)院附屬邵逸夫醫(yī)院張譯尹以及西湖大學(xué)雷雨斌為該課題提供了支持和幫助���。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息�����,如作者信息標(biāo)記有誤�����,或侵犯您的版權(quán),請聯(lián)系我們����,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com