近日�����,復(fù)旦大學(xué)研究團(tuán)隊(duì)在國際期刊《Cell Death&Disease》上發(fā)表了題為“Knockdown of TACC3 inhibits tumor cell proliferation and increases chemosensitivity in pancreatic cancer”的研究論文,本文中���,研究人員利用TCGA數(shù)據(jù)庫��,發(fā)現(xiàn)TACC3在PDAC中的高表達(dá)與不良預(yù)后相關(guān)��。研究人員通過藥物抑制TACC3或KIF11可抑制腫瘤細(xì)胞增殖并促進(jìn)凋亡�。TACC3和KIF11的高表達(dá)介導(dǎo)了胰腺癌細(xì)胞對吉西他濱的耐藥�����,而TACC3和KIF11的低表達(dá)增加了胰腺癌細(xì)胞對化療的敏感性��。綜上所述�,本研究揭示了TACC3在PDAC細(xì)胞增殖和化療耐藥中的基本作用�����,提示TACC3可作為評估PDAC預(yù)后的分子標(biāo)志物��。
研究背景
胰腺導(dǎo)管腺癌(PDAC)是一種高度致死性的消化系統(tǒng)惡性腫瘤�,總體5年生存率僅為10%�����。近年來���,PDAC的發(fā)病率在全球范圍內(nèi)呈上升趨勢����,目前已成為全球第三大癌癥死亡原因����。手術(shù)仍是PDAC患者根治性治療手段,但絕大多數(shù)患者在首次發(fā)現(xiàn)腫瘤時(shí)已因疾病進(jìn)展而失去手術(shù)機(jī)會��。新輔助化療可能為部分患者帶來切除的希望��,但仍需要更有效的循證治療方案。同樣�����,盡管靶向治療和免疫治療是很有前景的治療方法��,但它們并沒有取得足夠的進(jìn)展���。
TACC3是TACC家族成員之一。TACC3被認(rèn)為在控制微管成核和穩(wěn)定性方面起重要作用���。在人類卵母細(xì)胞減數(shù)分裂和哺乳動物體細(xì)胞有絲分裂過程中��,TACC3參與雙極紡錘體的形成和組裝�����。TACC3的高表達(dá)可能與某些人類癌癥有關(guān)���。在乳腺癌、肺癌����、前列腺癌、成人白血病/淋巴瘤等多種癌癥中,TACC3均出現(xiàn)異常表達(dá)�,TACC3高表達(dá)通常與預(yù)后不良相關(guān)。TACC3是目前腫瘤診斷和預(yù)后預(yù)測的重要分子標(biāo)志物�����,但TACC3在腫瘤發(fā)生中的具體機(jī)制和作用仍有待進(jìn)一步闡明��。研究人員提示TACC3在胰腺癌中具有促癌作用��,但其具體功能和機(jī)制尚未進(jìn)一步探討��。
研究進(jìn)展
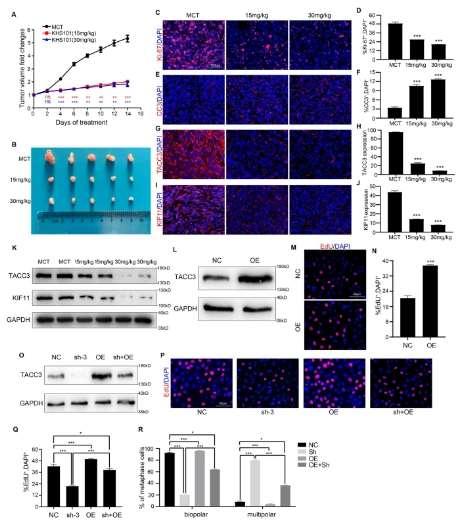
KHS101是TACC3的有效抑制劑�。KHS101處理大鼠海馬神經(jīng)祖細(xì)胞可顯著降低TACC3水平,抑制鼻咽癌的進(jìn)展��。在膠質(zhì)母細(xì)胞瘤中����,KHS101的一系列類似物已被證明通過抑制TACC3功能具有顯著的抗腫瘤細(xì)胞增殖活性,有望被開發(fā)用于膠質(zhì)母細(xì)胞瘤的治療��。為了研究降低PDAC中TACC3蛋白的表達(dá)是否可以抑制腫瘤的進(jìn)展�,研究人員用Panc-1細(xì)胞構(gòu)建了小鼠皮下腫瘤模型,并以MCT����、15 mg/kg KHS101或30 mg/kg KHS101的濃度梯度每日治療小鼠����。通過記錄腫瘤體積變化����,研究人員發(fā)現(xiàn)KHS101顯著抑制小鼠PDAC的進(jìn)展(圖1A, B)。治療14天后收集所有腫瘤標(biāo)本���。皮下腫瘤組織冷凍切片�����,Ki-67和CC3 IF染色檢測PDAC細(xì)胞的增殖和凋亡情況。研究人員發(fā)現(xiàn)�����,與對照小鼠(mct處理)相比����,KHS101處理小鼠的PDAC細(xì)胞增殖明顯降低(圖1C, D),凋亡增強(qiáng)(圖1E, F)��。此外,通過對皮下腫瘤中TACC3和KIF11的IF染色��,研究人員證實(shí)KHS101處理顯著降低了TACC3的表達(dá)(圖1G, H)��,并且這種降低伴隨著KIF11表達(dá)的降低(圖1I���,圖1I)����。這些結(jié)果表明����,在小鼠中應(yīng)用TACC3抑制劑,降低TACC3蛋白的表達(dá)水平���,可以有效抑制PDAC的進(jìn)展���,有望為PDAC的治療提供新的思路。上述結(jié)果提示KHS101可顯著降低PDAC中TACC3的表達(dá)�,抑制腫瘤進(jìn)展。
圖1:TACC3抑制劑在體內(nèi)抑制PDAC的進(jìn)展
接下來�����,研究人員進(jìn)行了TACC3挽救實(shí)驗(yàn)。首先�,研究人員在H6C7正常人胰管上皮細(xì)胞中過表達(dá)TACC3,觀察其對增殖的影響��。Western blotting驗(yàn)證TACC3過表達(dá)的效率(圖1L)�。EdU實(shí)驗(yàn)顯示,TACC3過表達(dá)導(dǎo)致細(xì)胞增殖增加(圖1M, N)�。因此,接下來���,研究人員將在TACC3缺陷細(xì)胞中過表達(dá)TACC3���,看看是否可以挽救TACC3敲低導(dǎo)致的增殖限制。以野生型Panc-1細(xì)胞(NC)為對照組����,構(gòu)建過表達(dá)tacc3的Panc-1細(xì)胞(OE)���。接下來����,通過使用靶向TACC3非編碼區(qū)3 ' UTR的TACC3 shRNA�,研究人員構(gòu)建了TACC3敲低的Panc-1細(xì)胞(sh-3)�。上述實(shí)驗(yàn)表明����,體內(nèi)外均可通過降低TACC3的表達(dá)抑制PDAC細(xì)胞的增殖和進(jìn)展,而升高TACC3的表達(dá)可增強(qiáng)細(xì)胞的增殖���。綜上所述��,TACC3對PDAC細(xì)胞的增殖以及PDAC在體內(nèi)和體外的發(fā)育都是至關(guān)重要的�。
研究結(jié)論
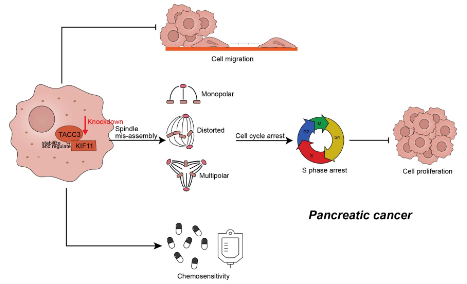
綜上����,研究表明,TACC3是PDAC的啟動子��,通過調(diào)節(jié)雙極紡錘體的形成�,促進(jìn)細(xì)胞周期的進(jìn)展,并支持PDAC細(xì)胞的惡性表型����。敲低TACC3及其下游蛋白KIF11可抑制腫瘤細(xì)胞增殖并增加PDAC的化療敏感性(圖2)。本研究結(jié)果表明����,TACC3可以作為PDAC的一種新的分子標(biāo)記物和有希望的治療靶點(diǎn)�����。
圖2:TACC3敲低抑制腫瘤細(xì)胞增殖和遷移�,增加胰腺癌的化療敏感性�。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息�,如作者信息標(biāo)記有誤,或侵犯您的版權(quán)��,請聯(lián)系我們���,我們將在及時(shí)修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com