近日,華中科技大學(xué)研究人員在國(guó)際期刊《Cell Reports Medicine》上發(fā)表了題為“Engineering irradiated tumor-derived microparticles as personalized vaccines to enhance anti-tumor immunity”的研究論文��,該研究中���,研究人員介紹了一種利用輻射后的腫瘤細(xì)胞衍生微粒(RT-MPs)構(gòu)建疫苗的策略��,該疫苗具有個(gè)性化和廣譜的抗原庫�����,可誘導(dǎo)全面的抗腫瘤效應(yīng)�。研究人員利用SARS-CoV-2刺突蛋白和TGFBR2開發(fā)了RT-MPs����。該刺突蛋白和TGFBR2高表達(dá)誘導(dǎo)固有免疫應(yīng)答,改善免疫抑制性TME��,從而促進(jìn)T細(xì)胞活化和浸潤(rùn)���,終抑制腫瘤生長(zhǎng)����。本研究為生產(chǎn)有效的個(gè)體化抗腫瘤疫苗提供了策略。
研究背景
個(gè)性化腫瘤疫苗通過增強(qiáng)或利用患者的免疫系統(tǒng)來對(duì)抗腫瘤細(xì)胞�����,在癌癥治療中受到了廣泛關(guān)注�����。然而�,許多I期臨床試驗(yàn)顯示�,在激活免疫反應(yīng)和減少?gòu)?fù)發(fā)方面效果有限。這些令人不滿意的結(jié)果是由于以下幾個(gè)因素造成的:(1)腫瘤抗原的可獲得性低�����,(2)腫瘤抗原的免疫原性弱�����,(3)免疫抑制的腫瘤微環(huán)境(TME)����,(4)抗原呈遞細(xì)胞(APCs)數(shù)量不足���,無法誘導(dǎo)足夠的細(xì)胞毒性T細(xì)胞(ctl),(5)活化的ctl浸潤(rùn)很小;還有許多其他可能的原因����。因此,既能提供高可用性的強(qiáng)免疫原性腫瘤抗原來激活A(yù)PC�,又能改善免疫抑制性TME的可行方法,是引發(fā)有效的抗腫瘤免疫應(yīng)答和實(shí)現(xiàn)臨床效益所必需的�。
為了克服這些缺陷,實(shí)驗(yàn)室之前已經(jīng)探索了一種方法��,即利用輻射誘導(dǎo)的旁觀者效應(yīng)(RIBE)的潛在機(jī)制�����,即輻射在癌細(xì)胞和鄰近未輻照的細(xì)胞或組織中引起氧化應(yīng)激和DNA損傷���,導(dǎo)致免疫原性死亡并誘導(dǎo)抗腫瘤作用��。研究人員發(fā)現(xiàn)輻照腫瘤細(xì)胞源性微顆粒(RT-MPs)��,一種由輻照腫瘤細(xì)胞釋放的細(xì)胞質(zhì)膜源性細(xì)胞外囊泡�,增加抗原呈遞。誘導(dǎo)RT-MPs的釋放不僅可以導(dǎo)致腫瘤細(xì)胞鐵死亡�����,還可以將腫瘤相關(guān)巨噬細(xì)胞(TAM)重編程為具有病原體殺傷能力的m1樣促炎表型����,從而表現(xiàn)出抗腫瘤作用。因此�,輻射可以誘導(dǎo)一種新的免疫肽,可能作為有效的抗原����。這種特性使RT-MPs成為遞送抗原和激活A(yù)PC的理想載體,使其成為腫瘤疫苗的優(yōu)秀佐劑���。
研究進(jìn)展
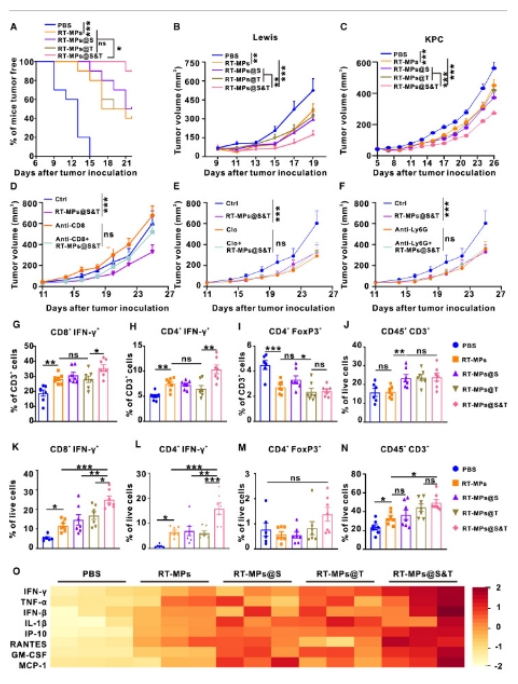
到目前為止,研究人員已經(jīng)發(fā)現(xiàn)過表達(dá)SARS-CoV-2刺突蛋白激活apc���,而過表達(dá)TGFΒR2可改善免疫抑制性TME并促進(jìn)T細(xì)胞向腫瘤部位遷移���。研究人員同時(shí)加入RT-MPs@S和RT-MPs@T,測(cè)試10 ng/mL TGF-β對(duì)bmms的聯(lián)合作用�。如圖所示,RT-MPs@S和RT-MPs@T聯(lián)合使用對(duì)BMDMs的激活和TGF-β的消耗作用較強(qiáng)。因此���,研究人員認(rèn)為將這兩種微粒結(jié)合在一起�����,在防止腫瘤形成和抑制腫瘤生長(zhǎng)方面會(huì)產(chǎn)生更強(qiáng)的反應(yīng)����。首先�����,研究人員測(cè)試了工程化RT-MPs對(duì)C57BL/6小鼠的預(yù)防作用��。然后皮內(nèi)注射PBS�、RT-MPs、RT-MPs@S���、RT-MPs@T和RT-MPs@S&T�����,每2天注射一次��,共6天�����。研究人員在一次疫苗注射10天后皮下注射Lewis腫瘤細(xì)胞����。如5A所示,RT-MPs可以有效地阻止腫瘤的形成�。與RT-MPs相比,RT-MPs@S或RT-MPs@T在抑制腫瘤生長(zhǎng)方面表現(xiàn)出更顯著的效果��。RT-MPs@S&T在預(yù)防和抑制腫瘤生長(zhǎng)方面的作用較強(qiáng)���。在腫瘤細(xì)胞接種21天后���,RT-MPs@S& t處理組中只有10%的小鼠(1 / 10)形成腫瘤。
圖5:RT-MPs@S&T顯示出增強(qiáng)抗腫瘤免疫和抑制腫瘤生長(zhǎng)的能力
為了評(píng)估這些佐劑和疫苗的使用如何轉(zhuǎn)化為患者的治療��,研究人員試圖確定這些微粒在腫瘤形成后的作用��。在這里����,研究人員建立了皮下Lewis瘤。腫瘤達(dá)到50 mm3后�,小鼠被隨機(jī)分為5個(gè)治療組:PBS、RT-MPs���、RT-MPs@S�、RT-MPs@T和RT-MPs@S&T�����。與RT-MPs���、RT-MPs@S和RT-MPs@T相比�����,RT-MPs@S&T顯著抑制了腫瘤生長(zhǎng)(圖5B)����。研究人員還利用小鼠胰腺導(dǎo)管腺癌(PDAC)細(xì)胞系構(gòu)建了另一個(gè)腫瘤模型�����,該細(xì)胞系來源于KrasG12D和trp53r172h突變的本地小鼠PDAC (KPC)模型的晚期原發(fā)腫瘤�����。研究人員在KPC細(xì)胞上過表達(dá)刺突蛋白和TGFBR2,并獲得RT-MPs RT-MPs@S和RT-MPs@T��。如圖5C所示���,與RT-MPs相比�����,RT-MPs@S&T顯著抑制了腫瘤生長(zhǎng)���。綜上所述,這些結(jié)果表明RT-MPs@S&T在體內(nèi)具有非常強(qiáng)的預(yù)防和治療抗腫瘤作用���。
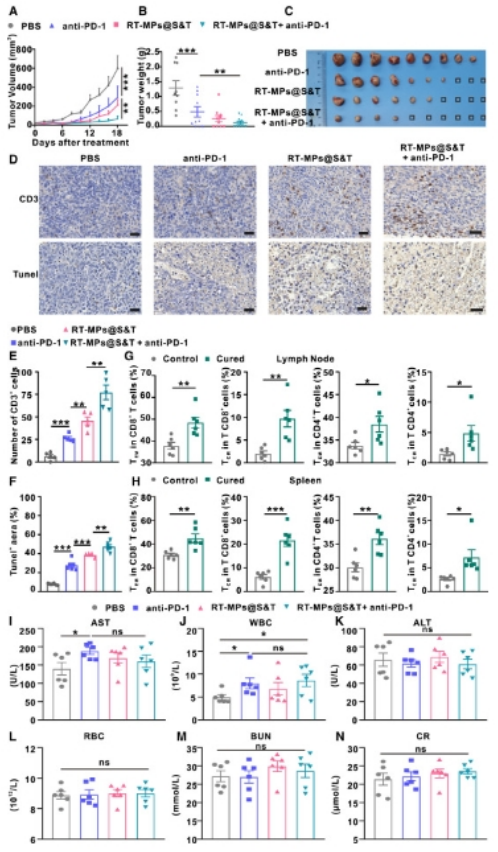
為了評(píng)估RT-MPs@S&T與抗pd -1聯(lián)合使用的生物相容性�,研究人員在PBS����、RT-MPs@S&T、抗pd -1以及RT-MPs@S&T與抗pd -1聯(lián)合使用后15天采集小鼠血液和組織���。研究人員觀察到白細(xì)胞(WBC)和谷草轉(zhuǎn)氨酶(AST)的數(shù)量增加�����,但在正常范圍內(nèi)(圖6I和6J)�。四組患者紅細(xì)胞(rbc)���、丙氨酸轉(zhuǎn)氨酶(ALT)�����、血尿素氮(BUN)��、肌酐(CR)的變化均無顯著性差異(圖6K-6N)����。此外����,小鼠的體重在四個(gè)治療組之間沒有顯著差異。心�����、肝��、脾、肺����、腎的組織病理學(xué)檢查顯示,RT-MPs@S&T治療或聯(lián)合治療均未影響這些主要器官����。總之�����,這些數(shù)據(jù)表明�,RT-MPs和工程化RT-MPs用于潛在的腫瘤疫苗是安全的。
圖6:含有RT-MPs@S&T和抗pd -1的治療具有抗腫瘤作用����,并產(chǎn)生免疫記憶
研究結(jié)論
綜上,研究人員描述了一種開發(fā)個(gè)體化抗腫瘤疫苗的策略���,該疫苗基于使用RT-MPs作為個(gè)體化和廣泛抗原庫的載體��,通過基因工程在兩個(gè)方面進(jìn)行修飾:一是利用SARS-CoV-2刺突蛋白增強(qiáng)RT-MPs激活先天免疫的能力�����,二是通過過表達(dá)TGFΒR2降低局部TGF-β濃度���,改善免疫抑制微環(huán)境。研究人員還表明���,使用含有SARS-CoV-2刺突蛋白并過表達(dá)TGFΒR2的RT-MPs可以緩解T細(xì)胞被困在淋巴結(jié)中的問題�,從而使T細(xì)胞無法有效地被募集到局部腫瘤�,從而促進(jìn)T細(xì)胞向腫瘤部位的浸潤(rùn)。隨著患者個(gè)性化治療策略的迫切需求的增加�,本疫苗設(shè)計(jì)有望為針對(duì)肺癌的免疫治療和針對(duì)其他實(shí)體腫瘤的個(gè)性化癌癥疫苗提供思路和方法。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán),請(qǐng)聯(lián)系我們���,我們將在及時(shí)修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com