諾華公司(Novartis)今天宣布�,美國FDA批準(zhǔn)Fabhalta(iptacopan)上市�����,作為治療成人陣發(fā)性夜間血紅蛋白尿癥(PNH)的一個口服單藥療法����。Fabhalta是一種補體B因子抑制劑����,它在免疫系統(tǒng)的替代補體途徑中起作用,全面控制血管內(nèi)外的紅細(xì)胞(RBC)破壞�����。臨床試驗顯示��,F(xiàn)abhalta在大多數(shù)患者中有效提高血紅蛋白水平���,并且在3期臨床試驗APPLY-PNH中����,幾乎所有使用Fabhalta的患者都沒有接受輸血。這款藥物被行業(yè)媒體Evaluate列為10款值得關(guān)注的潛在重磅療法之一��。
FDA的批準(zhǔn)基于3期臨床試驗APPLY-PNH�。該試驗包括血紅蛋白<10 g/dL且以前接受過抗C5療法治療但仍有殘余貧血的患者。結(jié)果顯示�����,F(xiàn)abhalta在提高血紅蛋白水平和避免輸血方面優(yōu)于繼續(xù)使用抗C5療法治療的患者�����。批準(zhǔn)還得到了3期臨床試驗APPOINT-PNH的支持���,該研究針對未接受過補體抑制劑治療的患者�����。APPLY-PNH和APPOINT-PNH試驗24周的主要發(fā)現(xiàn)包括:
82.3%接受過抗C5療法治療的患者在無輸血的情況下���,接受Fabhalta治療后血紅蛋白水平持續(xù)增加≥2 g/dL,繼續(xù)接受抗C5療法治療的患者這一數(shù)值為0%(P<0.0001)�。未接受過補體抑制劑治療的患者中,77.5%的患者接受Fabhalta治療后達(dá)到了這一結(jié)果�����。
在無輸血的情況下,67.7%接受過抗C5療法治療的患者血紅蛋白水平持續(xù)≥12 g/dL���,繼續(xù)接受抗C5療法治療的患者這一數(shù)值為0%(P<0.0001)�。
對于接受過抗C5療法治療的患者�����,接受Fabhalta治療后避免輸血率為95.2%��,而抗C5療法組患者這一數(shù)值為45.7%(P<0.0001)���。
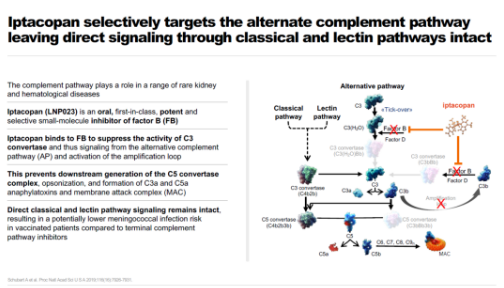
Iptacopan簡介(圖片來源:諾華公司官網(wǎng))
在APPLY-PNH試驗中,F(xiàn)abhalta與抗C5療法相比報告的不良反應(yīng)(≥10%)包括:頭痛(19%比3%)�,鼻咽炎(16%比17%),腹瀉(15%比6%)��,腹痛(15%比3%)�,細(xì)菌感染(11%比11%),惡心(10%比3%)和病毒感染(10%比31%)����。在APPOINT-PNH試驗中����,報告的不良反應(yīng)(≥10%)包括頭痛(28%)�,病毒感染(18%),鼻咽炎(15%)和皮疹(10%)�。在APPLY-PNH中,接受Fabhalta治療的PNH患者中有兩名(3%)報告了嚴(yán)重的不良反應(yīng)���,包括腎盂腎炎���、尿路感染和COVID-19。在APPOINT-PNH中���,接受Fabhalta治療的PNH患者中有兩名(5%)報告了嚴(yán)重的不良反應(yīng)�,包括COVID-19和細(xì)菌性肺炎���。
Fabhalta是諾華公司的重點研發(fā)項目之一�����,除了用于治療PNH�,它在治療IgA腎病的3期臨床試驗中也已達(dá)到主要終點�,預(yù)計于2024年遞交加速批準(zhǔn)的監(jiān)管申請���。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息�,如作者信息標(biāo)記有誤,或侵犯您的版權(quán)�����,請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com