Cell Stem Cell:腎臟類器官模型揭示多囊腎病治療新靶點
多囊腎病(PKD)是常見的遺傳性腎臟疾病之一����,其特征是腎臟中形成充滿液體的囊腫。常染色體顯性多囊腎?�。ˋDPKD)和常染色體隱性多囊腎病(ARPKD)是多囊腎病常見的形式��。大多數(shù)多囊腎病患者會在五六十歲時進(jìn)展到終末期腎臟疾病��,此時需要進(jìn)行透析或腎移植�。
目前,對于多囊腎病的治療選擇有限�����,托伐普坦是被FDA批準(zhǔn)的藥物�,可以減緩ADPKD患者的囊腫生長����,但其不良反應(yīng)和成本可能會減少其臨床使用。此外���,由于獲取多囊腎病患者組織進(jìn)行活檢存在限制�����,直接研究人類多囊腎病發(fā)病機(jī)制具有挑戰(zhàn)性�����。這些未解決的問題凸顯了開發(fā)新的實驗?zāi)P鸵越沂径嗄夷I病的新機(jī)制和治療方法的緊迫性�。
2024年1月4日,新加坡南洋理工大學(xué)夏云��、Foo Jia Nee和Altos Labs的 Juan Carlos Izpisua Belmonte 作為共同通訊作者����,在 Cell Stem Cell 期刊發(fā)表了題為:Kidney organoid models reveal cilium-autophagy metabolic axis as a therapeutic target for PKD both in vitro and in vivo 的研究論文。
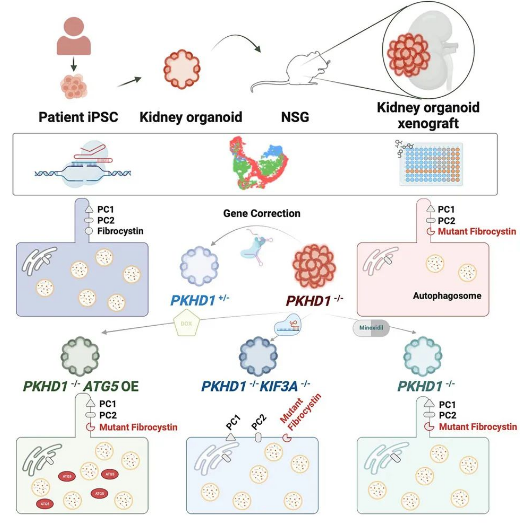
該研究開發(fā)了體外和體內(nèi)的多囊腎病腎臟類器官模型�����,并表現(xiàn)出腎小管損傷和腎素-血管緊張素-醛固酮系統(tǒng)(RAAS)異常上調(diào)����,通過體內(nèi)多囊腎病生長類器官模型揭示了纖毛-自噬代謝軸多囊腎病的治療新靶點����,進(jìn)而證明了一種FDA批準(zhǔn)的自噬激活劑——米諾地爾(Minoxidil)�����,可以有效地減輕體內(nèi)多囊腎病腎臟內(nèi)器官的囊腫形成。
這種體內(nèi)多囊腎病腎臟類器官模型將增強(qiáng)我們發(fā)現(xiàn)多囊腎病新的疾病機(jī)制和驗證臨床轉(zhuǎn)化候選藥物的能力。
在過去幾年中���,已經(jīng)建立了基因編輯的人多能干細(xì)胞(hPSC)來源的腎臟類器官、多囊腎病患者細(xì)胞誘導(dǎo)的iPSC來源的腎臟類器官�,以及成人組織來源的腎小管類器官����,用來模擬人類多囊腎病�。這些類器官模型能夠在體外產(chǎn)生管狀囊腫,是研究多囊腎病的有價值的工具�����。然而�,大多數(shù)多囊腎病的體外類器官模型需要應(yīng)激刺激或長期培養(yǎng)才能表現(xiàn)出囊腫形成�����。已有研究表明���,將人多能干細(xì)胞(hPSC)來源的腎臟類器官植入免疫受損小鼠體內(nèi)可以有效促進(jìn)移植類器官的結(jié)構(gòu)和功能成熟���。然而���,多囊腎病的腎臟類器官從未在活體組織中進(jìn)行過研究���。
近期的遺傳學(xué)研究揭示了與多囊腎病相關(guān)的多個基因�。雖然多囊腎病的類器官模型易于進(jìn)行遺傳操作�����,但很少有人探索使用類器官模型研究這些新發(fā)現(xiàn)的多囊類器官相關(guān)基因的發(fā)病機(jī)制的可行性��。雖然攜帶不同遺傳病變的多囊腎病患者表現(xiàn)出不同的疾病表型,但揭示共同的發(fā)病途徑將為開發(fā)針對不同形式的多囊腎病的治療方法奠定基礎(chǔ)����。
囊性腎是纖毛病常見的特征之一�����,然而,初級纖毛在人類PKD中的作用尚未完全了解,這可能是由于缺乏用于研究的實驗?zāi)P?�。使用動物模型和臨床樣本的研究表明�,多囊腎病中存在多種代謝通路失調(diào),包括糖酵解和自噬��。雖然初級纖毛是自噬的重要調(diào)節(jié)器�,但目前尚不清楚初級纖毛和自噬之間的串?dāng)_(crosstalk)是否在多囊腎病中失調(diào)�。
為了回答這些問題����,研究團(tuán)隊生成了一系列攜帶不同致病基因的常染色體顯性多囊腎?���。ˋDPKD)和常染色體隱性多囊腎?�。ˋRPKD)的腎臟類器官。這些多囊腎病腎臟類器官移植到免疫缺陷小鼠體內(nèi)后�����,自發(fā)地發(fā)生了腎小管囊腫��,表現(xiàn)為腎小管損傷和腎素-血管緊張素-醛固酮系統(tǒng)(RAAS)的異常上調(diào)。在體外和體內(nèi)���,自噬的恢復(fù)足以保護(hù)多囊腎病腎臟類器官免受囊腫形成的影響��。
單細(xì)胞分析揭示了囊腫形成過程中的多種代謝變化�����,包括細(xì)胞自噬缺陷。通過ATG5基因的過表達(dá)來激活自噬�����,能夠顯著抑制多囊腎病腎臟類器官的囊腫形成���。此外,初級纖毛的消融也可以通過上調(diào)自噬來抑制囊腫形成�����。
通過使用自發(fā)性產(chǎn)生囊腫的多囊腎病腎臟類器官異種移植模型�����,證明了一種FDA批準(zhǔn)的自噬激活劑——米諾地爾(Minoxidil)�,可以有效地減輕體內(nèi)多囊腎病腎臟內(nèi)器官的囊腫形成,因此可作為一種有前途的治療多囊腎病的候選藥物�����。
總的來說����,該研究開發(fā)的體外和體內(nèi)的多囊腎病腎臟類器官模型��,將增強(qiáng)我們發(fā)現(xiàn)多囊腎病新的疾病機(jī)制和驗證臨床轉(zhuǎn)化候選藥物的能力�。
新加坡南洋理工大學(xué)夏云課題組的劉萌�、張超、龔喜明和張?zhí)駷檎撐墓餐髡?��,新加坡南洋理工大學(xué)夏云�、Foo Jia Nee和Altos Labs的 Juan Carlos Izpisua Belmonte 為論文共同通訊作者��。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息���,如作者信息標(biāo)記有誤,或侵犯您的版權(quán)����,請聯(lián)系我們,我們將在及時修改或刪除內(nèi)容�����,聯(lián)系郵箱:marketing@360worldcare.com