Cell子刊:新型基因療法����,有望阻止?jié)u凍癥進(jìn)展����,計(jì)劃兩年內(nèi)進(jìn)行人體試驗(yàn)
肌萎縮側(cè)索硬化癥(ALS,俗稱漸凍癥)和額顳葉癡呆(FTD)是兩種進(jìn)行性�、成人發(fā)病的神經(jīng)退行性疾病�����,分別由運(yùn)動(dòng)皮層和脊髓中的運(yùn)動(dòng)神經(jīng)元以及額葉和顳葉中的皮層神經(jīng)元的細(xì)胞死亡引起��。
ALS 是一種運(yùn)動(dòng)神經(jīng)元疾?。∕ND)�����,會(huì)導(dǎo)致大腦和脊柱與肌肉溝通的神經(jīng)元逐漸喪失����。在早期階段���,患者會(huì)出現(xiàn)肌肉無(wú)力���,但隨著疾病的進(jìn)展,他們逐漸失去獨(dú)立行走�����、說話��、吞咽和呼吸的能力。大多數(shù) ALS 患者在診斷后兩到五年內(nèi)死亡���。雖然有一種基因療法有望治療一種家族性 ALS�����,但對(duì)于占所有病例 90% 的散發(fā)性 ALS���,幾乎沒有可用的治療方法。其中���,有效的只能將患者的生命延長(zhǎng)至多五個(gè)月��。所有這些都需要頻繁服用���,有些還伴有難以應(yīng)對(duì)的副作用。
FTD 是一種較為罕見的癡呆癥���,但它是 65 歲以下人群中第二常見癡呆癥�。該病并不總是有明顯的身體癥狀���,但它會(huì)導(dǎo)致認(rèn)知能力下降����,并伴有行為癥狀,包括焦慮�����、失去抑制��、性格改變和判斷力受損����。患者確診后可能存活 10 多年��,但終是致命的����。目前 FTD 尚無(wú)治療方法����。
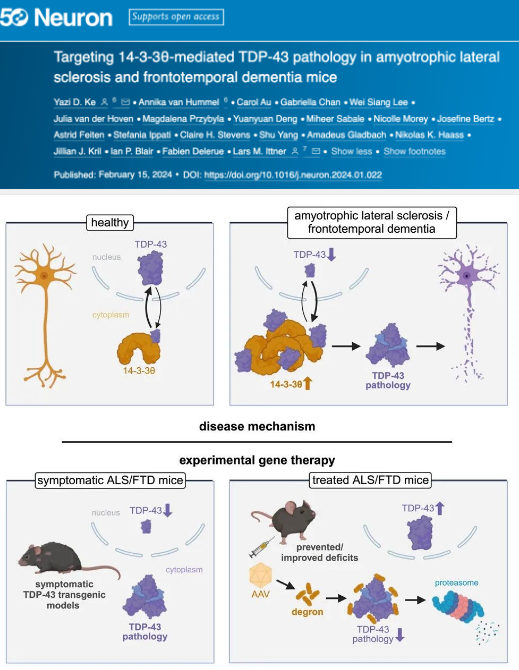
在健康的神經(jīng)元中,核 TAR 結(jié)合蛋白 43(TDP-43)是自然產(chǎn)生的����,對(duì)其健康功能很重要���。然而,TDP-43 在合成后可能會(huì)被修飾�����,導(dǎo)致其在細(xì)胞的錯(cuò)誤部位積累和聚集��,從而阻止它們正常工作����。這些積聚與毀滅性的神經(jīng)退行性疾病有關(guān),例如 ALS��、FTD 等��。
已有研究發(fā)現(xiàn)����,兩種疾病的神經(jīng)病理學(xué)特征是核 TAR 結(jié)合蛋白 43(TDP-43)的細(xì)胞質(zhì)沉積。因此����,TDP-43 的細(xì)胞質(zhì)重新定位是 ALS/FTD 發(fā)病機(jī)制中的關(guān)鍵事件,但其潛在機(jī)制仍不清楚。
近日��,來(lái)自澳大利亞麥考瑞大學(xué)的神經(jīng)研究人員發(fā)現(xiàn)����,14-3-3θ 蛋白和 TDP-43 之間存在相互作用,其調(diào)節(jié)后者的細(xì)胞質(zhì)重定位��。在具有 TDP-43 病理學(xué)的散發(fā)性 ALS 和 FTD 中���,14-3-3θ 蛋白水平也會(huì)升高�。致病性 TDP-43 與 14-3-3θ 的相互作用增加��,導(dǎo)致 TDP-43 在細(xì)胞質(zhì)中積累�、不溶、磷酸化和斷裂����,類似于疾病的病理變化。14-3-3θ 蛋白屬于 14-3-3 蛋白家族�����,已知該家族通過與其他蛋白結(jié)合來(lái)調(diào)節(jié)其他蛋白���,并且它們?cè)诟鞣N細(xì)胞過程中發(fā)揮作用�,包括信號(hào)傳導(dǎo)����、生存和細(xì)胞分化。
利用 14-3-3θ 對(duì)致病性 TDP-43 增加的親和力����,研究人員設(shè)計(jì)了一種針對(duì) TDP-43 病理學(xué)的基因治療載體,該載體減輕了表達(dá)突變或非突變 TDP-43 的不同 ALS/FTD 小鼠模型的功能缺陷和神經(jīng)變性����,包括在治療時(shí)已經(jīng)出現(xiàn)癥狀的情況。
相關(guān)研究以:Targeting 14-3-3θ-mediated TDP-43 pathology in amyotrophic lateral sclerosis and frontotemporal dementia mice 為題����,發(fā)表在了 Neuron 期刊上。
這項(xiàng)研究的通訊作者是麥考瑞大學(xué)癡呆癥研究中心主任和醫(yī)學(xué)���、健康與人文科學(xué)學(xué)院生物醫(yī)學(xué)科學(xué)系教授 Lars Ittner��,他在理解阿爾茨海默病和額顳葉癡呆的基本病理機(jī)制方面作出了重大貢獻(xiàn)�����,并確定了這些疾病藥物開發(fā)的幾個(gè)新靶點(diǎn)��。
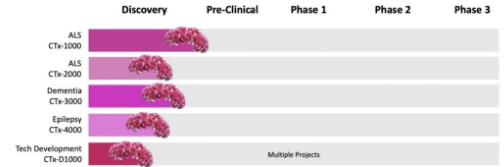
在過去的 15 年里�,Lars Ittner 和他的團(tuán)隊(duì)一直在研究病理性 TDP-43 的積累?���!斑@兩種蛋白質(zhì)相互作用,導(dǎo)致這些蛋白質(zhì)在細(xì)胞中堆積���。由此����,我們能夠分離出控制這種相互作用的短肽�,并基于此開發(fā)了名為 CTx1000 的單劑量基因療法?��!?/span>
CTx1000 針對(duì)的是大腦和脊髓細(xì)胞中 TDP-43 蛋白的病理性積聚���,這種蛋白與 ALS、FTD 和其他形式的癡呆癥有關(guān)����?����!爱?dāng)我們?cè)趯?shí)驗(yàn)室中使用它時(shí),它會(huì)溶解堆積物�,標(biāo)記 TDP-43 蛋白以供人體回收,并防止新蛋白的形成���。重要的是����,CTx1000 僅針對(duì)病理性 TDP-43�����,從而允許產(chǎn)生健康版本的蛋白質(zhì)并不受阻礙地發(fā)揮其作用����。”
Lars Ittner 表示���,CTx1000 在他們的研究中沒有顯示出任何副作用�。該論文的主要作者 Yazi Ke 博士指出���,在實(shí)驗(yàn)室條件下�����,CTx1000 即使在晚期階段也能阻止 ALS 和 FTD 的進(jìn)展�,并解決與 FTD 相關(guān)的行為癥狀。
盡管 CTx1000 主要針對(duì) ALS 和 FTD 進(jìn)行測(cè)試���,但它也有望治療更常見的癡呆癥���,例如阿爾茨海默病。通過靶向和清除病理性 TDP-43����,該療法有可能減輕癥狀并阻止目前缺乏有效治療方案的幾種神經(jīng)退行性疾病的進(jìn)展。
該療法由麥考瑞大學(xué)的一家衍生公司 Celosia Therapeutics 推進(jìn)�。該公司成立于 2022 年,致力于開發(fā)針對(duì)神經(jīng)退行性疾病的療法�。Lars Ittner 正是該公司的創(chuàng)始人,他希望能夠在兩年內(nèi)將 CTx1000 推進(jìn)到人體臨床試驗(yàn)階段��,他們已經(jīng)從 FightMND 獲得了 120 萬(wàn)美元的臨床前資助來(lái)協(xié)助這一過程����。然而����,進(jìn)行人體試驗(yàn)的估計(jì)成本為 2200 萬(wàn)美元�����,研究團(tuán)隊(duì)正在積極尋求投資來(lái)支持這一關(guān)鍵階段����。
該公司的另外一位創(chuàng)始人 Roger Chung 系麥考瑞大學(xué)醫(yī)學(xué)���、健康與人類科學(xué)學(xué)院神經(jīng)生物學(xué)和神經(jīng)化學(xué)教授兼副院長(zhǎng)�。其領(lǐng)導(dǎo)研究項(xiàng)目近 20 年���,開發(fā)了用于神經(jīng)保護(hù)和神經(jīng)再生的肽療法(已授權(quán)給一家 ASX 上市公司)���。他的研究項(xiàng)目在生物化學(xué)、細(xì)胞和分子生物學(xué)���、蛋白質(zhì)組學(xué)和疾病動(dòng)物模型方面擁有廣泛的專業(yè)知識(shí)�。
聲明:本文版權(quán)歸原作者所有��,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤�����,或侵犯您的版權(quán)�,請(qǐng)聯(lián)系我們,我們將在及時(shí)修改或刪除內(nèi)容�����,聯(lián)系郵箱:marketing@360worldcare.com