寧波大學新研究:發(fā)現(xiàn)“癌中之王”胰腺癌耐藥機制和預后靶點
近日����,寧波大學研究團隊在期刊《Cell Death Discovery》上在線發(fā)表題為“LncRNA MACC1-AS1 induces gemcitabine resistance in pancreatic cancer cells through suppressing ferroptosis”的研究論文����,本研究發(fā)現(xiàn)了一種新的細胞內信號通路��,在胰腺癌的吉西他濱耐藥中發(fā)揮作用��。通過一系列的探索和驗證�����,這一發(fā)現(xiàn)可能為未來臨床應用提供新的見解和理論基礎�����。
研究背景
胰腺癌是一種罕見的惡性腫瘤��,僅占所有癌癥病例的2%–3%����。然而����,它與7%的顯著高死亡率相關�����。目前����,吉西他濱是胰腺癌常用的化療藥物����。遺憾的是,吉西他濱治療胰腺癌的總體緩解率低于20%��,80%的患者在1年內復發(fā)并死亡���。盡管吉西他濱在晚期轉移患者中具有一定效果��,但其結果并不令人滿意��,這主要歸因于耐藥性的發(fā)展�。
鐵死亡是一種鐵依賴性��、脂質過氧化物積累驅動的調節(jié)性細胞死亡過程�����。研究表明,胰腺癌細胞利用與鐵死亡相關的抗氧化系統(tǒng)來清除活性氧(ROS)���,作為逃避細胞死亡的策略��。Nrf2-ARE通路在細胞抗氧化應激反應中發(fā)揮重要作用��。此外���,Keap1-Nrf2通路通過調節(jié)下游靶基因SLC7A11的表達水平抑制鐵死亡�����。
大量研究強調了非編碼RNA�����,如microRNA(miRNA)和長鏈非編碼RNA(lncRNA)在鐵死亡調控中的作用��。其中����,MACC1-AS1已被確認為MACC1 mRNA的反義RNA。研究表明��,MACC1-AS1通過腺苷活化蛋白激酶/Lin28通路穩(wěn)定MACC1的表達水平,促進細胞行為�,包括胃癌細胞的增殖和侵襲。盡管一些lncRNA與胰腺癌細胞的耐藥性有關���,但目前還沒有關于MACC1-AS1與胰腺癌細胞耐藥關系的研究���。
研究進展
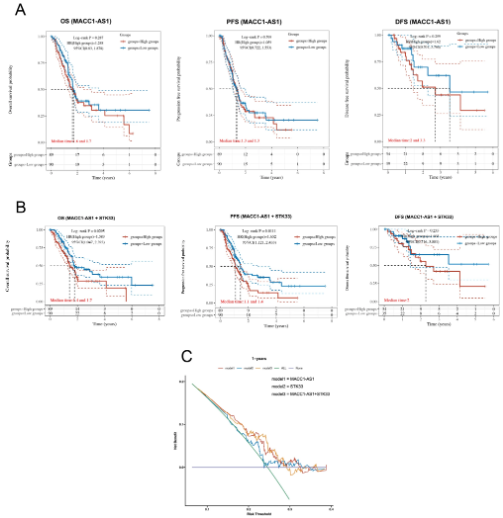
在臨床應用方面,嘗試分析了胰腺癌患者中MACC1-AS1��、STK33以及兩者基因的表達水平及其預后意義�。首先將患者分為高風險組和低風險組。然后��,展示了兩組的生存狀態(tài)���,并顯示了熱圖���,代表MACC1-AS1和MACC1-AS1+STK33的基因表達水平。KM生存曲線顯示����,高風險組的患者與低風險組的患者在OS、PFS和DFS率方面具有不同的中位生存時間。結果顯示�����,MACC1-AS1的高表達表明胰腺癌患者OS���、PFS和DFS的生存時間較差�����,但無統(tǒng)計學意義���。然而,發(fā)現(xiàn)MACC1-AS1和STK33的組合對OS和PFS率均有顯著影響���。結果表明,MACC1-AS1和STK33的聯(lián)合分析在OS和PFS方面呈現(xiàn)出統(tǒng)計學意義(P < 0.05)���,而對DFS仍然沒有意義����。
此外����,與單獨使用基因表達相比�,這種聯(lián)合方法表現(xiàn)出更優(yōu)越的性能����。建立了MACC1-AS1、STK33和兩者的決策曲線分析(DCA)���,計算了每位患者的風險評分�,并使用“ggDCA” R軟件包獲得了不同的DCA模塊���?���;颊弑环譃槲鍌€模塊�。根據(jù)DCA分析結果,MACC1-AS1和STK33的聯(lián)合預后效果表現(xiàn)出更高的DCA值���,表明多基因模型對1年OS具有更強的預測能力�。這些數(shù)據(jù)表明�����,MACC1-AS1和STK33可以作為胰腺癌患者臨床預后的聯(lián)合靶點。
研究結論
綜上所述,本研究發(fā)現(xiàn)了一種新的細胞內信號通路,在胰腺癌的吉西他濱耐藥中發(fā)揮作用����。通過一系列的探索和驗證����,這一發(fā)現(xiàn)可能為未來臨床應用提供新的見解和理論基礎�����。
聲明:本文版權歸原作者所有�����,轉載文章僅為傳播更多信息�,如作者信息標記有誤,或侵犯您的版權����,請聯(lián)系我們�����,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com