四川大學朱青/韓俊宏團隊發(fā)現(xiàn)胰腺癌轉移新機制
3月5日�,四川大學朱青�、韓俊宏共同通訊在期刊《Oncogene》上在線發(fā)表題為“tiRNA-Val-CAC-2 interacts with FUBP1 to promote pancreatic cancer metastasis by activating c?MYC transcription”的研究論文,研究結果強調了胰腺癌轉移的潛在新機制����,并表明tiRNA-Val-CAC-2和FUBP1都可以作為胰腺癌有前景的預后生物標志物和潛在治療靶點。
研究背景
胰腺癌已成為一個突出的公共衛(wèi)生問題��,其發(fā)病率和死亡率都很高���。根據(jù)2020年全球癌癥數(shù)據(jù)統(tǒng)計���,胰腺癌的發(fā)病率和死亡率分別排名第14位和第7位�,預計到2030年將成為癌癥死亡的第二大原因��。胰腺癌患者通常在早期階段沒有明顯特異性臨床癥狀����,因此往往在晚期被診斷,有很高的轉移傾向�����。特別是�����,肝臟經常成為胰腺癌轉移的主要目的地�,導致中位生存期不足12個月,從而對人類健康構成嚴重威脅����。因此,篩選和識別胰腺癌的早期診斷標志物或潛在治療靶點對改善患者的生活質量和預后具有重要意義���。
非編碼RNA(ncRNA)是一類無法編碼蛋白質的RNA���。最近����,對ncRNA在腫瘤中的調控功能及其與腫瘤發(fā)生發(fā)展的交互關系的研究已成為生物醫(yī)學領域的熱點話題����。tRNA衍生小RNA(tsRNA)是由特異性核酸酶(如Dicer和血管生成素)在特定細胞或組織中切割tRNA環(huán)而產生的15-40nt大小的小片段RNA。越來越多證據(jù)表明���,tsRNA具有廣泛的生物學功能�����,包括參與細胞和組織應激反應、蛋白質翻譯調控����、干細胞生物學、核糖體生物發(fā)生���、轉座子調控等�����。
研究發(fā)現(xiàn)
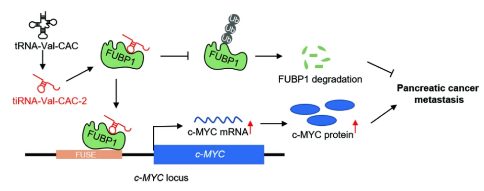
在這項研究中����,研究人員發(fā)現(xiàn)了226個tsRNA在原發(fā)性和轉移性胰腺癌患者中有顯著差異表達,包括120個上調和106個下調的tsRNA����。值得注意的是,tiRNA-Val-CAC-2在胰腺癌患者的轉移病灶中顯著上調�。tiRNA-Val-CAC-2的過表達促進了胰腺癌細胞的遷移和侵襲,而tiRNA-Val-CAC-2的敲低抑制了這些過程����。進一步的機制研究揭示了tiRNA-Val-CAC-2可以與RNA結合蛋白FUBP1相互作用,導致FUBP1蛋白穩(wěn)定性增加����,進而通過c-MYC轉錄進一步促進胰腺癌的轉移。綜合而言���,研究發(fā)現(xiàn)揭示了一種tsRNA(tiRNA-Val-CAC-2)調節(jié)胰腺癌轉移的新機制�,表明tiRNA-Val-CAC-2和FUBP1可以作為胰腺癌有希望的治療靶點�。
研究結論
綜上所述,研究結果強調了胰腺癌轉移的潛在新機制��,并表明tiRNA-Val-CAC-2和FUBP1都可以作為胰腺癌有前景的預后生物標志物和潛在治療靶點。
聲明:本文版權歸原作者所有�����,轉載文章僅為傳播更多信息���,如作者信息標記有誤���,或侵犯您的版權,請聯(lián)系我們�����,我們將在及時修改或刪除內容����,聯(lián)系郵箱:marketing@360worldcare.com