利用AI預測胃癌對抗HER2療法及其聯(lián)合免疫療法的反應
2024年8月26日,北京大學腫瘤醫(yī)院沈琳團隊在期刊《Signal Transduction and Targeted Therapy》上發(fā)表了題為“Predicting gastric cancer response to anti-HER2 therapy or anti-HER2 combined immunotherapy based on multi-modal data”的研究論文���。團隊引入了一種稱為多模態(tài)(MuMo)的深度學習模型�����,該模型集成了患者的研究數據��,以做出精確的治療反應預測����。研究結果不僅強調了多模態(tài)數據分析�,在加強HER2陽性胃癌治療評估和個性化用藥方面的重要性,還強調了模型的潛力和臨床價值����。
研究背景
胃癌(GC)是全球第五大常見的癌癥,也是中國第二大常見的癌癥��。大約15-30%的晚期胃或胃食管交界處腺癌�,表現(xiàn)出人表皮生長因子受體2(ERBB2/HER2)的擴增或過表達。這種生物標志物的異質性�����,對有效治療構成了重大挑戰(zhàn),患者之間的反應差異很大����。曲妥珠單抗治療GC試驗顯示,不到一半的HER2陽性患者對曲妥珠單抗和化療的聯(lián)合治療有反應�,表明患者內部和腫瘤間的顯著變異性。使治療前景進一步復雜化的��,是KEYNOTE-811研究的中期結果��,盡管在標準治療中加入pembrolizumab作為一線治療�,可顯著提高客觀緩解率,但這并不等同于所有患者的總生存期(OS)的統(tǒng)一提高�����。
人工智能(AI)作為開發(fā)多模態(tài)模型的創(chuàng)新工具的潛力很大���,其優(yōu)勢在于�����,它能夠分析不同的數據類型����,并在特征級別集成它們。然而���,AI在預測治療反應方面的應用�����,仍處于起步階段,特別是用于預測復雜疾?����。ㄈ?GC)���。預測治療反應����,需要更精細的數據集��。此外����,治療數據集的不完整性,對AI模型構建和學習過程,提出了技術挑戰(zhàn)�。在現(xiàn)實的抗HER2治療或抗HER2聯(lián)合免疫治療情況下,患者的影像學病史也許僅部分可用����。
為了應對這些挑戰(zhàn),本研究旨在使用全面的分析方法����,來準確預測接受抗HER2治療或其聯(lián)合免疫治療的GC患者的治療反應。團隊收集了一個包含429名患者的綜合多中心數據集�����,整合了基線治療階段的各種信息模式�����,包括放射學計算機斷層掃描(CT)�����、病理全玻片圖像�、放射學和病理報告,以及一般的患者信息��。團隊的研究,集中在北京大學腫瘤醫(yī)院接受治療的兩個不同的患者隊列:抗HER2(接受抗HER2治療和化療的患者和其聯(lián)合免疫治療(接受抗HER2治療聯(lián)合抗PD-1/PD-L1免疫檢查點抑制劑[ICI]和化療的患者)隊列�����。團隊開發(fā)了一個統(tǒng)一的����、基于transformer的深度學習模型,稱為Multi-Mo dal模型(MuMo)���,它有效地結合了多模態(tài)輸入,來預測治療反應��。研究結果表明����,MuMo能夠從多模態(tài)數據中提取互補的見解,并提供更準確的治療反應預測����。
研究進展
MuMo在抗HER2隊列中的預測性能
MuMo在預測抗HER2隊列的治療反應方面,顯示出有希望的療效�,曲線下面積(AUC)評分為 0.821(95%置信區(qū)間[CI]:0.692-0.949)。此外��,MuMo表現(xiàn)出令人印象深刻的治療所需數量,值為1.83(95%CI:1.28–4.24)�,表明其在預測治療反應方面效率很高。MuMo的預測性能��,超過了類似測試中6名臨床醫(yī)生的預測性能�,甚至與這些臨床醫(yī)生的咨詢綜合評分相匹配。MuMo在區(qū)分無反應者和反應者方面�,表現(xiàn)出很強的區(qū)分能力,AUC評分為0.884(95%CI:0.745–1.000)��。這一表現(xiàn)突出了MuMo在多中心數據案例中的有效性���。團隊還利用兩個公共數據集�,展示了MuMo框架的靈活可擴展性:用于胃腺癌的TCGA-STAD和用于浸潤性乳腺癌的TCGA-BRCA���。團隊根據MuMo的預測評分����,將每個隊列分為高風險組和低風險組���。低風險組表現(xiàn)出更長的無進展生存期(PFS)和OS增加�。在獨立測試集中�,兩組之間的中位OS����,存在顯著差異(高風險組為6個月�����,低風險組為17個月) �。
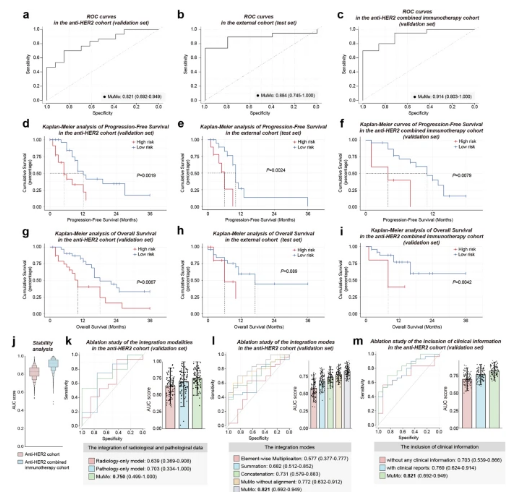
多模態(tài)模型(MuMo)的性能。a-c 受試者工作特征(ROC)曲線顯示了MuMo在預測治療反應���、區(qū)分無反應者和反應方面的表現(xiàn)���。這些曲線與抗HER2隊列的驗證和測試集以及抗HER2聯(lián)合免疫治療隊列的驗證集有關。d-f Kaplan-Meier(KM)曲線描述了基于MuMo預測的無進展生存期(PFS)�。這些曲線來自抗HER2隊列的驗證和測試集以及抗HER2聯(lián)合免疫治療隊列的驗證集��。在Kaplan-Meier分析中�����,使用Youden指數將患者分為高風險(紅線)和低風險(藍線)組��。對數秩(Mantel-Cox)檢驗用于確定統(tǒng)計顯著性����,雙側P值<0.05為顯著性��。g-i Kaplan-Meier(KM)曲線顯示基于抗HER2隊列驗證和測試集���,以及抗HER2聯(lián)合免疫治療隊列驗證集的MuMo預測的總生存期(OS)。j MuMo在治療反應預測中的穩(wěn)定性分析��。評估放射學和病理學數據整合(k)���、各種整合模式的影響(l)��,以及MuMo中臨床信息的納入的消融研究(m)��。誤差線表示 AUC分數的95%置信區(qū)間(CI)
MuMo在預測抗HER2聯(lián)合免疫治療隊列反應方面的適應性
在該隊列中���,MuMo表現(xiàn)出卓越的性能,AUC為0.914 (95%CI:0.803–1.000)���,表明響應預測的準確性很高���。此外,MuMo在PFS方面�����,熟練地區(qū)分高風險組和低風險組(對數秩檢驗,P = 0.0079)和OS(對數秩檢驗��,P=0.0042)����,這對患者的預后和治療計劃至關重要。這一令人印象深刻的表現(xiàn)��,凸顯了MuMo在適應相對較新的治療方案(例如���,抗HER2聯(lián)合免疫療法)方面的關鍵作用����,其中����,臨床醫(yī)生的經驗和歷史數據可能有限��。MuMo等高級深度學習模型����,能夠從各種隊列中提取有意義的見解����,這表明它們在新興治療場景中�,具有廣泛應用的潛力。
MuMo在治療反應預測方面的一貫穩(wěn)定性
研究結果表明�,MuMo表現(xiàn)出較小的性能變異性,這是其在預測治療反應方面�����,始終如一的穩(wěn)定性和可靠性的關鍵指標��。MuMo在小組咨詢中����,表現(xiàn)出的性能變異性,顯著低于個體臨床醫(yī)生及其集體決策過程 (Levene 檢驗�,P< 0.05)。此外�����,團隊在5組隨機變化的醫(yī)生注釋中�����,證明了MuMo的穩(wěn)定預測性能 (AUC 0.800至0.833)。這些結果凸顯了MuMo在治療反應場景中��,提供可靠和穩(wěn)定預測的能力���。
HER2陽性GC患者的多模式數據分析的全面概述���。該圖說明了團隊研究方法的分步工作流程,從數據收集到使用的分析技術��。重點介紹了關鍵結果�,證明了MuMo對HER2陽性GC患者治療反應的高度預測準確性。
研究結論
MuMo的靈活性����,使其成為跨學科合作的理想平臺,促進生物信息學家���、臨床醫(yī)生和數據科學家之間的知識融合���。通過這樣的合作,MuMo可以不斷吸收新的研究發(fā)現(xiàn)和臨床反饋�,以迭代更新和完善其算法����。此外�����,MuMo 框架具有高度可擴展性���,可以迅速擴展到其他癌癥類型和診斷標志物。通過對特定隊列進行有針對性的再訓練����,MuMo可以迅速適應不同的癌癥,如乳腺癌或其他臨床相關的免疫組織化學(IHC)標志物�,如ER、PR和EGFR���。這種適應性不僅增強了該模型在各種腫瘤學應用中的實用性�����,而且還支持更全面的個性化醫(yī)療方法�。此外�����,團隊希望探索使用從可穿戴設備和遠程監(jiān)測工具收集的數據,例如�,患者的活動水平和生理反應,這可以為模型提供全面的健康信息�,以實現(xiàn)更準確的個性化治療。
總而言之��,MuMo代表了一種很有前途的策略�����,可以利用AI功能來提高接受抗HER2或其聯(lián)合免疫治療的GC患者的反應預測準確性����。通過采用全面的多模式數據集,團隊在實現(xiàn)個性化治療策略方面�����,取得了重大進展��。該模型令人印象深刻地證明了多種模式和AI的潛在整合�,為未來的腫瘤學研究,提供了一個令人興奮的方向��。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息�����,如作者信息標記有誤�����,或侵犯您的版權����,請聯(lián)系我們��,我們將在及時修改或刪除內容����,聯(lián)系郵箱:marketing@360worldcare.com


