信號素3D如何重塑巨噬細胞�����,加速胰腺癌侵襲
2024年10月16日�,約翰霍普金斯大學醫(yī)學院鄭雷團隊在期刊《Science Advances》上發(fā)表了題為“Semaphorin 3D promotes pancreatic ductal adenocarcinoma progression and metastasis through macrophage reprogramming”的研究論文���。這項研究表明����,改變的SEMA3D表達導致獲得促癌功能,并且神經來源的SEMA3D被PDA細胞“劫持”���,以支持KRAS中的生長和轉移MUT-dependent方式。
關于胰腺導管腺癌
胰腺導管腺癌(PDA)是一種令人沮喪的惡性疾病��,是癌癥相關死亡的第三大原因�����,與其他癌癥類型相比�����,生存率較低�,為12%。神經周圍浸潤(PNI)是腫瘤細胞侵襲到神經或周圍神經的腫瘤��,是PDA的一個特征���,發(fā)生在80%至100%的人類PDA中����,并且與患者預后不良和侵襲性腫瘤特征有關 ���。
在近期一項PDA的單核和空間轉錄組分析研究中��,軸突引導分子與PNI和不良預后有關 ����。團隊之前對膜聯(lián)蛋白A2(一種PDA相關腫瘤抗原和轉移相關蛋白)調節(jié)的信號通路的分析,確定了分泌蛋白信號3D(SEMA3D)及其輔助受體叢蛋白D1(PLXND1)和神經纖毛蛋白-1�,通過自分泌和旁分泌信號傳導,參與增加神經遷移和PDA細胞侵襲性�����,以促進PDA進展和轉移�����。
TME信號轉導可以將巨噬細胞重編程為M2樣巨噬細胞��,這既可以支持PDA的進展和轉移���,也可以影響免疫療法的療效��。在這項研究中�����,團隊使用PDA的基因工程小鼠模型����,驗證了腫瘤和神經來源的SEMA3D都通過巨噬細胞重編程,促進腫瘤進展和轉移的假設���。
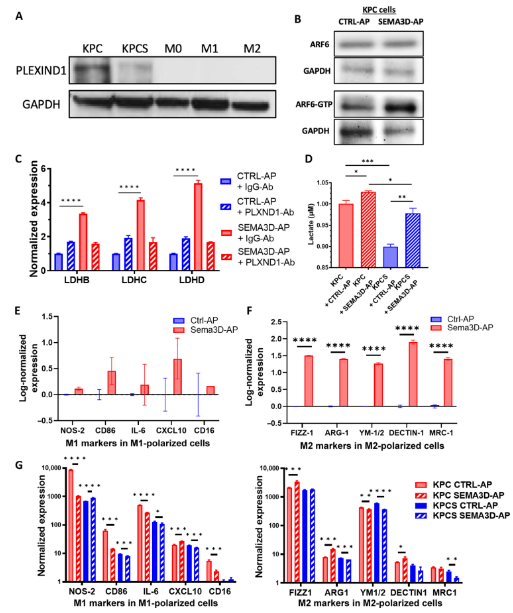
SEMA3D通過ARF6信號傳導和PDA腫瘤細胞中乳酸的產生,間接重編程巨噬細胞
外源性SEMA3D增加了PDA腫瘤細胞中的糖酵解基因表達和乳酸分泌���;然而�����,外源性SEMA3D的能力���,可能受到腫瘤細胞中內源性SEMA3D丟失的限制,因此�,不足以補償KPCS小鼠腫瘤上皮細胞中SEMA3D的丟失。
在含有CTRL-AP或SEMA3D-AP的培養(yǎng)基中��,用KPC細胞培養(yǎng)的極化M1細胞中��,未觀察到顯著的M1基因表達變化��。然而,與CTRL-AP處理的KPC細胞共培養(yǎng)的M2極化細胞相比����,與經SEMA3D-AP處理的KPC細胞共培養(yǎng)的M2極化細胞,表現(xiàn)出M2基因標志物的表達顯著升高����。相比之下,當M1或M2極化巨噬細胞與KPCS細胞共培養(yǎng)時���,如上所述�����,M1或M2基因表達標志物沒有持續(xù)增加��,這可能是由于KPCS細胞中PLXND1表達的缺失����。這些結果表明��,SEMA3D在通過PDA腫瘤細胞進行巨噬細胞重編程中的作用��,是PLXND1依賴性的���。
SEMA3D通過PDA腫瘤細胞中的ARF6信號傳導和乳酸產生間接重編程巨噬細胞�。
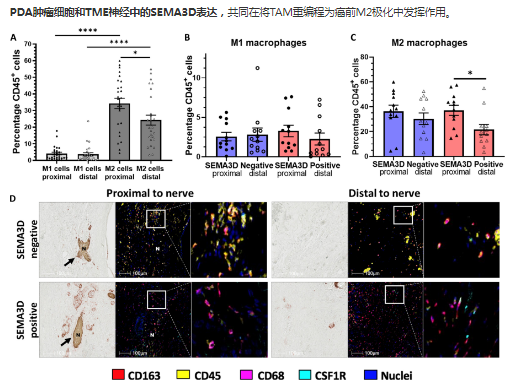
在表達PDA的人SEMA3D中,神經近端的M2巨噬細胞數量增加
M2樣TAM在人PDATME中占CD45細胞的比例較高���,而只有一小部分CD45細胞是M1樣TAM����。此外�����,在人類PDA中���,神經近端或遠端M1樣TAM的百分比,沒有顯著差異����。相比之下,與神經遠端區(qū)域相比����,在神經近端的TME區(qū)域,觀察到M2 TAM百分比顯著增加��。這些結果表明,瘤內神經使附近的巨噬細胞偏向M2極化�����,支持神經或神經元分泌的因子在巨噬細胞重編程中的作用���。
PDA腫瘤細胞和TME神經中的SEMA3D表達����,共同在將TAM重編程為癌前M2極化中發(fā)揮作用��。
在表達SEMA3D的人PDA中��,神經近端的M2巨噬細胞增加�。
總結
1. 軸突引導分子的作用:研究首次證實軸突引導分子在胰腺導管腺癌(PDA)的發(fā)展和轉移中的作用。
2. SEMA3D表達與TAM浸潤:研究表明SEMA3D表達與人類PDA TME中的TAM浸潤和極化相關��。
3. 癌癥治療的潛在靶點:研究證明了SEMA3D是癌癥治療的潛在靶點����,靶向SEMA3D的所有來源作為治療靶點至關重要。
4. 未來研究方向:未來的研究將集中在開發(fā)靶向SEMA3D的治療劑����,以及多個軸突引導分子如何協(xié)同促進PDA進展和轉移��。
聲明:本文版權歸原作者所有�,轉載文章僅為傳播更多信息����,如作者信息標記有誤,或侵犯您的版權�����,請聯(lián)系我們����,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com