首藥控股肺癌1類新藥申報(bào)上市
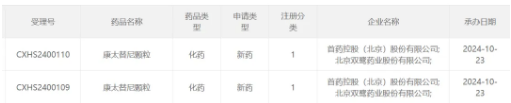
今日(10月23日)��,中國國家藥監(jiān)局藥品審評(píng)中心(CDE)官網(wǎng)公示����,首藥控股和雙鷺?biāo)帢I(yè)共同申報(bào)的1類新藥康太替尼顆粒上市申請(qǐng)獲得受理。根據(jù)首藥控股公告介紹,這是該公司自主研發(fā)的ALK抑制劑(研發(fā)代號(hào):CT-707 )��,本次申報(bào)上市的適應(yīng)癥為單藥治療間變性淋巴瘤激酶(ALK)陽性的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者�����。
截圖來源:CDE官網(wǎng)
非小細(xì)胞肺癌(NSCLC)約占肺癌的80%~85%�。由于患者基數(shù)龐大����,ALK陽性NSCLC雖然占比不高,但每年新發(fā)病例數(shù)仍不容忽視�����。
根據(jù)首藥控股的公告介紹�,2024年上半年,CT-707治療ALK陽性NSCLC患者的關(guān)鍵性3期臨床試驗(yàn)完整數(shù)據(jù)讀出���,主要研究終點(diǎn)結(jié)果達(dá)到方案預(yù)設(shè)的優(yōu)效標(biāo)準(zhǔn)����。該關(guān)鍵性3期臨床試驗(yàn)共納入414例既往較多接受過1線化療方案的治療���、且未接受過任何ALK抑制劑治療的ALK陽性晚期NSCLC患者�����,旨在比較CT-707與另一款A(yù)LK抑制劑治療的有效性和安全性�����。本研究證實(shí)��,與對(duì)照組相比���,CT-707在治療ALK陽性NSCLC患者中取得了顯著且有臨床意義的改善�����,安全性方面同樣展現(xiàn)出獨(dú)特的優(yōu)勢(shì)�。
根據(jù)首藥控股2024年半年度報(bào)告介紹���,在非小細(xì)胞肺癌這一大病種治療領(lǐng)域���,首藥控股重點(diǎn)布局了多款候選藥物,包括二代ALK抑制劑���、三代ALK/LTK抑制劑�����、高選擇性RET抑制劑��、KRAS(G12C)抑制劑等���。部分候選藥物之間協(xié)同效應(yīng)明顯���,有望通過聯(lián)合用藥覆蓋更多的適應(yīng)癥�����,提高腫瘤患者用藥可及性與生存獲益��。
此外�����,首藥控股還與正大天晴等公司合作研發(fā)了多款創(chuàng)新藥��,其中新一代ALK抑制劑TQ-B3139已經(jīng)獲批上市�,JAK抑制劑TQ05105處于上市審評(píng)階段,其余管線靶點(diǎn)還覆蓋了IDH1、DPP-4�、IDH2、CDK��、TRK���、BET等等��,適應(yīng)癥涵蓋癌癥和過敏性疾病��。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤�����,或侵犯您的版權(quán)��,請(qǐng)聯(lián)系我們���,我們將在及時(shí)修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com