中山大學張弩教授團隊:發(fā)現腫瘤免疫治療新靶點
10月30日����,中山大學張弩教授研究團隊在期刊《Cell Reports Medicine》上發(fā)表了研究論文��,題為“Lnc-H19-derived protein shapes the immunosuppressive microenvironment of glioblastoma”,本研究中�����,研究人員發(fā)現長鏈非編碼RNA (LncRNA) H19編碼一種稱為H19-IRP的免疫相關蛋白���。H19- irp從H19 RNA中分離出來���,通過與CCL2和Galectin-9啟動子結合并激活其轉錄,從而促進GBM免疫抑制���,進而招募髓源性抑制細胞(MDSCs)和腫瘤相關巨噬細胞(TAMs)�,導致T細胞耗竭和免疫抑制性GBM- TME���。H19-IRP在臨床GBM樣本中過表達����,作為主要組織相容性復合體I類(MHC-I)呈遞的腫瘤相關抗原(TAA)發(fā)揮作用。靶向H19-IRP的環(huán)狀RNA疫苗(circH19-vac)可觸發(fā)針對GBM的強效細胞毒性T細胞應答�,并抑制GBM生長。本研究結果強調了H19-IRP通過招募MDSCs和TAMs來產生免疫抑制性GBM-TME的功能����,支持了以H19-IRP為靶點的腫瘤疫苗用于GBM治療的想法。
背景信息
膠質母細胞瘤(GBM)是成人常見和致命的腦腫瘤�。由于治療方案有限,患者結局較壞�����,中位生存期不足2年����。盡管目前可用的免疫療法已被證明可使各種類型的癌癥患者獲益,包括結直腸癌�����、黑色素瘤�、非小細胞肺癌和腎細胞癌����,但在GBM的免疫療法臨床試驗中尚未證明滿意的療效和結局���。
GBM對目前的免疫治療方法顯示出顯著的耐藥性�。免疫檢查點阻斷(ICB)療法是目前主流的免疫療法���,旨在增強T細胞的抗腫瘤能力���。然而,GBM中密集的免疫抑制細胞�,加上稀疏的T細胞浸潤�����,嚴重限制了ICB的治療效力�。此外,免疫逃逸是包括GBM在內的惡性腫瘤的一個標志��。GBM可通過DNA甲基化等表觀遺傳修飾增強腫瘤微環(huán)境(tumor microenvironment�����, TME)免疫抑制,促進免疫逃逸�����。免疫治療失敗的原因是GBM-TME具有高度的免疫敵意����。免疫抑制性GBM-TME的機制是多方面的;影響因素包括腫瘤細胞的突變負荷低��、免疫抑制性髓系細胞的高浸潤����、效應T細胞的缺乏和有效抗原的缺乏。GBM免疫治療關鍵的挑戰(zhàn)是如何克服高度免疫抑制的TME����。
TME中的多種細胞群與免疫抑制的調節(jié)和促進腦癌進展有關。例如���,研究表明����,在GBM中����,骨髓來源的巨噬細胞傾向于表現出免疫抑制表型�����,從而促進腫瘤進展��。GBM的單細胞RNA測序(scRNA-seq)圖譜也顯示腫瘤的進展與免疫抑制細胞(如TAMs和MDSCs)的浸潤相一致��。具有免疫抑制作用的TME也會影響療效�。TME中缺乏細胞毒性T細胞��、記憶性T細胞�����、TH1細胞和其他淋巴細胞浸潤��,往往導致免疫治療效果不佳��?;谏鲜霭l(fā)現��,近年來的研究嘗試將“冷” TME轉變?yōu)椤盁帷?TME作為治療策略�����。然而,這些策略仍處于臨床前階段�,臨床獲益不確定。因此�����,迫切需要尋找更有效的靶點來改善或逆轉免疫抑制性GBM-TME��。
H19-IRP是一種TAA���,具有作為疫苗靶點的潛在價值
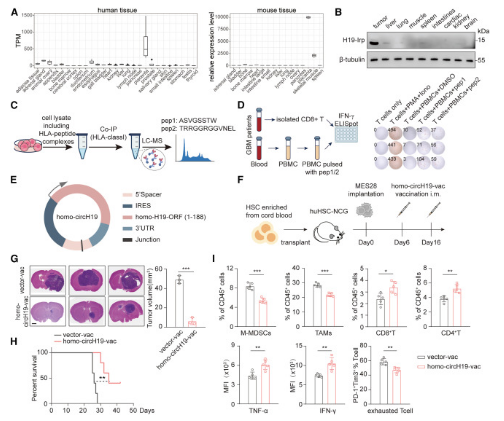
H19-IRP在腫瘤細胞中的高度特異性表達�����,提示H19-IRP可作為腫瘤疫苗的靶點����。接下來���,研究人員探討了H19-IRP作為疫苗靶點的可行性��。研究人員在GEO數據集中研究了人類和小鼠H19的表達�����,發(fā)現H19僅在人類和小鼠胎盤中高表達�,而在其他器官中相對低水平表達,這表明H19在一般人群的體細胞中呈低水平表達���。對GBM腫瘤組織和正常組織的免疫印跡也一致表明�����,H19-Irp在腫瘤組織中特別高表達�,而不是其他健康器官組織����。研究人員接下來研究了H19-IRP是否可以通過主要組織相容性復合體I類(MHC-I)呈現。研究人員在MES28中進行了人類白細胞抗原(HLA)-I免疫沉淀����,然后進行了MS。將質譜結果與H19-IRP序列進行匹配后���,研究人員鑒定出了兩個來源于H19-IRP的HLA - I結合肽。研究人員接下來研究了H19 - IRP來源的肽是否可以有效地激活CD8+T細胞。H19 - IRP來源的多肽與PBMCs共培養(yǎng)后��,外周血T細胞釋放大量的IFN-γ�。綜上所述,這些結果表明H19-IRP在腫瘤中特異性表達�����,并表現出相當的抗原免疫原性�����,提示其可能是一個有希望的腫瘤疫苗的靶點���。
H19-IRP是一種腫瘤相關抗原��,具有作為疫苗靶點的潛在價值
為了制備靶向H19-IRP的環(huán)狀RNA疫苗���,研究人員將H19-ORF線性合成circH19,并將circH19包被脂質納米顆粒(LNPs)�,制備環(huán)狀RNA疫苗(circH19-vac)。熒光素酶活性和H19-Irp水平發(fā)生顯著變化�,表明circH19在體外成功表達。接下來��,研究人員通過肌肉注射給小鼠circH19-vac。與空載體組相比�,circH19-vac組小鼠表現出更強的發(fā)光活性。這些數據表明�����,circH19-vac在體外和體內都能高效表達H19-IRP抗原�。
研究人員將免疫小鼠脾細胞與轉染circH19的骨髓來源樹突狀細胞(BMDCs)共培養(yǎng)24 h,采用IFN-γ酶聯(lián)免疫斑點法(ELISpot)檢測CD8+T細胞的活化情況�����。circH19疫苗接種小鼠的脾T細胞在體外被轉染circH19的BMDCs攻擊后釋放大量的IFN-γ����。為了進一步評估circH19-vac的治療潛力,研究人員通過疫苗接種策略免疫了攜帶GL261原位腫瘤的C57BL/6小鼠���。CircH19-vac顯著降低腫瘤體積�,延長生存期���。研究人員發(fā)現circH19-vac組小鼠的TME發(fā)生重塑���,M-MDSCs和TAMs減少����,CD8+和CD4+T細胞增多�����,T細胞殺傷能力增強�����,耗竭程度降低��。
為探索靶向人H19-IRP的疫苗的臨床應用潛力����,研究人員進一步設計了靶向人H19-IRP的疫苗��。為了保護這些免疫原性序列并避免潛在的促腫瘤作用����,研究人員選擇H19-IRP的1 ~ 188個氨基酸序列構建了人circH19 (homo-circH19),并在其表面涂以LNPs制備了環(huán)狀RNA疫苗(homo-circH19-vac)�����。為了評估homo-circH19-vac的治療效果,研究人員通過疫苗策略免疫了帶有MES28原位腫瘤的人源化小鼠模型huHSC-NCG小鼠�。與circH19-vac觀察到的效果一致,homo-circH19-vac顯著縮小了腫瘤體積�,延長了小鼠生存期。此外�,研究人員觀察到homo-circH19-vac組的TME發(fā)生重塑,M-MDSCs和TAMs減少�����,CD8+T細胞和CD4+T細胞增加�����,T細胞毒性增強����,T細胞耗竭水平降低。這些數據表明�����,利用LncRNA衍生的抗原肽的腫瘤疫苗可能是一種有效的腫瘤免疫治療策略�����。
結論
綜上所述,研究人員鑒定了一個之前未檢測到的蛋白����,H19-IRP,它在形成GBM的免疫抑制性TME中起著重要的作用���。環(huán)狀RNA疫苗circH19-vac的制備及其在臨床前模型中的療效強調了本研究的治療價值。因此�,H19-IRP是增強GBM免疫治療療效的一個安全且有前景的免疫治療靶點。
聲明:本文版權歸原作者所有���,轉載文章僅為傳播更多信息�,如作者信息標記有誤��,或侵犯您的版權���,請聯(lián)系我們���,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com