今日(12月6日)�����,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)新公示顯示�,諾和諾德申報(bào)的依柯胰島素司美格魯肽注射液上市申請獲得受理��。公開資料顯示���,這是諾和諾德研發(fā)的復(fù)方制品IcoSema���。諾和諾德在今年上半年投資者會議上公布了IcoSema在關(guān)鍵3期試驗(yàn)COMBINE 1當(dāng)中取得積極結(jié)果,并表示預(yù)定在今年下半年向中國�、美國、歐盟的監(jiān)管單位遞交該療法用于治療2型糖尿?����。═2D)患者的上市申請�����。由此推測�,IcoSema本次在中國申報(bào)上市的適應(yīng)癥為治療2型糖尿病。
IcoSema是每周一次依柯胰島素和每周一次司美格魯肽(semaglutide)的固定比例組合��。依柯胰島素是人胰島素類似物,其氨基酸結(jié)構(gòu)有三處進(jìn)行了替換��,并附加了C20二十烷脂肪二酸鏈���,使該分子能夠可逆地與白蛋白結(jié)合��,從而將半衰期延長至196小時(約7天)��,并在經(jīng)過3-4次每周一次注射后達(dá)到穩(wěn)定狀態(tài)�����。該療法被設(shè)計(jì)為一周一次皮下注射使用����。依柯胰島素已在歐盟�����、加拿大�、澳大利亞和日本獲得批準(zhǔn),在中國也于今年6月獲批上市��。司美格魯肽則是一種胰高糖素樣肽-1(GLP-1)類似物���,它通過突破性的肽鏈結(jié)構(gòu)優(yōu)化�,使得分子半衰期延長至7天����,實(shí)現(xiàn)了一周一次給藥且血藥濃度非常平穩(wěn)。
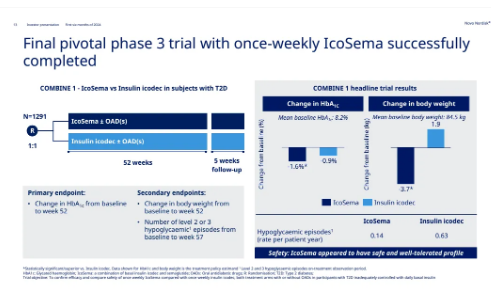
今年6月��,諾和諾德公布了IcoSema在關(guān)鍵3期試驗(yàn)COMBINE 1當(dāng)中取得積極結(jié)果���。COMBINE 1試驗(yàn)是一項(xiàng)國際性的3期試驗(yàn)���,旨在比較每周一次的IcoSema與每周一次的依柯胰島素(Icodec)在2型糖尿病患者中的血糖控制效果。該試驗(yàn)共招募1291位患者�����,隨機(jī)分配接受IcoSema或依柯胰島素治療共52周�����,并接續(xù)為期5周的隨訪��。
分析顯示,該試驗(yàn)達(dá)成主要終點(diǎn)���,與基線相較�����,IcoSema組患者的糖化血紅蛋白(HbA1c)水平在第52周時下降了1.6個百分點(diǎn)����,依柯胰島素組則下降了0.9個百分點(diǎn)��,差異具統(tǒng)計(jì)學(xué)意義���。而在次要終點(diǎn)上����,IcoSema組患者的體重在52周時下降了3.7公斤�����,依柯胰島素組患者則增加了1.9公斤����,兩組差異具統(tǒng)計(jì)學(xué)顯著性。
COMBINE 1試驗(yàn)設(shè)計(jì)與結(jié)果(圖片來源:參考資料[2])
此外,IcoSema組患者發(fā)生嚴(yán)重低血糖事件的概率(每患者每年發(fā)生0.14次)亦明顯低于使用依柯胰島素治療的患者(每患者每年發(fā)生0.63次)���。IcoSema在試驗(yàn)中展現(xiàn)良好的安全性與耐受性。
IcoSema針對2型糖尿病的開發(fā)共有三項(xiàng)后期研究�����。除了COMBINE 1�,諾和諾德在今年初公布了積極的COMBINE 3臨床3a期試驗(yàn)數(shù)據(jù),結(jié)果顯示�����,在679名使用每日一次基礎(chǔ)胰島素控制不佳的2型糖尿病患者中����,每周一次的IcoSema與每日注射一次的胰島素療法相比,在降低HbA1c上顯示具非劣效性��。
根據(jù)中國藥物臨床試驗(yàn)與信息公示平臺官網(wǎng)顯示����,諾和諾德已經(jīng)在中國完成一項(xiàng)IcoSema注射液針對2型糖尿病患者的1期臨床研究,即在中國2型糖尿病受試者中比較icodec胰島素和司美格魯肽單獨(dú)或同時給藥時作用特點(diǎn)�����。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán),請聯(lián)系我們�,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com