12月27日����,中國科學技術大學/安徽醫(yī)科大學研究人員合作共同在期刊《Cell Death&Disease》上發(fā)表了題為“GPR37-enhanced ubiquitination of ATP1A1 inhibits tumor progression and radiation resistance in esophageal squamous cell carcinoma”的研究論文����,本研究中���,GPR37 被確定為促進食管鱗狀細胞癌(ESCC)放射增敏的關鍵因素����。研究人員發(fā)現(xiàn) GPR37 在 ESCC 中低表達����,尤其是在對放療有耐藥的腫瘤中。從功能上看����,GPR37 不僅能夠克服 ESCC 的放療耐藥,還能抑制其增殖�����、遷移和侵襲。從機制上講���,GPR37 與 ATP1A1 蛋白相互作用�����,有效促進其泛素化誘導的降解�,從而限制 AKT/mTOR 信號通路的激活���。此外���,GPR37 可通過外泌體轉運至受體細胞,并抑制受體細胞的惡性行為�����?��?傮w而言�,這些研究結果表明�,GPR37-ATP1A1 軸有可能成為治療食管鱗狀細胞癌(ESCC)的治療靶點�,尤其是用于克服放射耐藥�����。
背景信息
食管癌在全球癌癥死亡率中排名第六�����,是世界上常見的胃腸道癌癥之一�。它主要分為兩種類型:食管腺癌(EAC)和食管鱗狀細胞癌(ESCC)����,后者約占所有病例的 90%。通常����,局部晚期 ESCC 采用放療(RT)、放化療(CRT)或新輔助 CRT 后手術治療�����。因此���,放療在治療方案中起著核心作用��,尤其是對于那些無法或不愿接受手術的 ESCC 患者�����。然而����,接受放療的患者中多達 80% 因腫瘤復發(fā)或放射場內的遠處轉移而治療失敗。這種失敗部分歸因于存在放療耐藥細胞���,無論是固有的還是由放療誘導的��。因此�����,放療在 ESCC 患者中的療效對其預后至關重要�,這凸顯了更深入地了解 ESCC 進展和放療耐藥的分子基礎及靶點的必要性�。
GPR37 屬于 GPCRs家族,也被稱為Pael-R����。GPR37 在中樞神經(jīng)系統(tǒng)中高度表達,迄今為止的大多數(shù)研究都集中在它與神經(jīng)疾病的關系上���,包括帕金森病�����、炎癥��、疼痛���、自閉癥和腦瘤。在腫瘤學領域����,已有證據(jù)表明 GPR37 在某些類型腫瘤的惡性進展中發(fā)揮著關鍵作用。值得注意的是����,它已被觀察到能增強肺癌和結腸癌的增殖和轉移。相反�,在肝細胞癌和多發(fā)性骨髓瘤細胞黏附模型中,GPR37 的表達降低�����,其下調與這些腫瘤的進展和不良預后有關�����。因此,GPR37 的確切功能取決于腫瘤類型����。尤其是,在之前的一項研究中��,研究人員發(fā)現(xiàn) GPR37 是在放療耐藥性衍生的食管鱗狀細胞癌(ESCC)細胞系中表達下調顯著的基因�����。然而��,GPR37 的表達及其調控機制��、確切的生物學功能����,尤其是其在 ESCC 放療耐藥中的作用和機制仍不清楚。
GPR37 抑制食管鱗狀細胞癌細胞的增殖�、遷移和侵襲能力
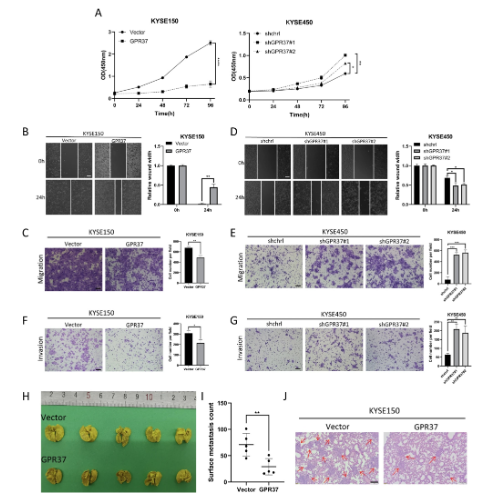
研究發(fā)現(xiàn)表明,GPR37 表達水平較低的 ESCC 組織可能會出現(xiàn)細胞增殖��、侵襲和轉移增加的情況���。從功能上看���,CCK-8 檢測表明����,GPR37 過表達的 KYSE150 細胞增殖顯著減少�,而 GPR37 敲低的 KYSE450 細胞增殖活性增加。傷口愈合實驗顯示��,GPR37 過表達的 KYSE150 細胞的傷口愈合速度比對照細胞慢�����。與此一致的是����,遷移實驗表明��,GPR37 過表達時細胞遷移減少�。相反,GPR37 敲低增強了 KYSE450 細胞的遷移能力����。此外��,GPR37 還顯著降低了 ESCC 細胞的侵襲能力����,這一點通過侵襲實驗得到了證實�。另外,研究人員的觀察還表明����,在 GPR37 過表達的情況下,E-鈣黏蛋白的蛋白表達顯著上升�,而 N-鈣黏蛋白的表達則有所下降。此外����,GPR37 還顯著抑制了驅動上皮間質轉化(EMT)的關鍵轉錄因子 Slug 的表達。這表明 GPR37 能夠抑制 EMT����,從而抑制食管鱗狀細胞癌(ESCC)的細胞遷移和侵襲。
圖1:GPR37 過表達和敲低對食管鱗狀細胞癌增殖�����、遷移和侵襲的影響
隨后,為了評估 GPR37 對食管鱗狀細胞癌(ESCC)體內轉移的影響����,研究人員采用了肺轉移模型。研究人員將 10 只 Balb/c 裸鼠隨機分為兩組���,每組 5 只����,一組接受 KYSE150 細胞尾靜脈注射����,另一組接受過表達 GPR37 的 KYSE150 細胞尾靜脈注射。九周后���,研究人員對可見的肺轉移結節(jié)進行了計數(shù)和分析。圖 1H���、I 中的數(shù)據(jù)表明�,接受過表達 GPR37 的 KYSE150 細胞的裸鼠肺部轉移結節(jié)數(shù)量顯著減少�。對肺轉移病灶進行蘇木精 - 伊紅(H&E)染色進一步證實了這些發(fā)現(xiàn)。
總之�����,證據(jù)表明 GPR37 是食管鱗狀細胞癌細胞進展的抑制因子。
外泌體 GPR37 能夠影響食管鱗狀細胞癌細胞的行為和放射敏感性
體內實驗表明Exo-GPR37也能抑制食管鱗癌的增殖�。劃痕實驗、遷移實驗和凋亡實驗表明����,Exo-GPR37分別抑制食管鱗癌細胞的遷移、侵襲和增強其放射敏感性���。蛋白質免疫印跡實驗結果顯示���,Exo-GPR37通過AKT/mTOR信號通路對ESCC細胞發(fā)揮作用。研究人員將PKH26標記的外泌體與HEEC細胞進行共培養(yǎng)實驗��。研究結果表明����,HEEC細胞對外泌體的內化效率明顯低于ESCC細胞。研究人員還評估了放療后HEEC的凋亡比例����。這些發(fā)現(xiàn)表明,GPR37通過外泌體介導調節(jié)受體細胞內的蛋白水平��,而外泌體又有可能調節(jié)腫瘤表型。這一見解表明����,增強外泌體的治療潛力可能是提高ESCC治療療效的可行策略。
結論
本研究證明���,GPR37 能夠抑制食管鱗狀細胞癌(ESCC)細胞的增殖����、轉移和放射耐藥�����。GPR37 水平可作為 ESCC 細胞增殖和轉移行為的生物學指標�����,以及導致放射耐藥的關鍵基因��。它是 ESCC 臨床治療中一個很有前景的重要分子靶點��。
聲明:本文版權歸原作者所有����,轉載文章僅為傳播更多信息,如作者信息標記有誤��,或侵犯您的版權��,請聯(lián)系我們�,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com