近日��,美國FDA在"Orbis計(jì)劃"框架下批準(zhǔn)了西雅圖遺傳學(xué)公司(Seattle Genetics公司)旗下的HER2特異性抑制劑Tukysa(tucatinib)的上市申請����,與曲妥珠單抗和卡培他濱聯(lián)用�����,用于手術(shù)無法切除或轉(zhuǎn)移性經(jīng)治晚期HER2陽性乳腺癌成人患者的治療���。這是FDA在"Orbis計(jì)劃"框架下批準(zhǔn)的一個(gè)新分子實(shí)體�����,對"Orbis計(jì)劃"的實(shí)施和乳腺癌的治療來說都具有"里程碑"意義���。
一.關(guān)于Tukysa(tucatinib)
圖一 Tukysa(tucatinib)結(jié)構(gòu)式
Tukysa(tucatinib���,結(jié)構(gòu)式見圖一)是一種小分子口服酪氨酸激酶抑制劑(TKI),對HER2具有優(yōu)異的靶向選擇性�。2019年曾被FDA授予突破性療法資格(BTD)��,與曲妥珠單抗和卡培他濱聯(lián)聯(lián)用�����,用于治療接受過曲妥珠單抗�、帕妥珠單抗、T-DM1(ado-trastuzumab emtansine)治療的局部晚期���、不可切除性或轉(zhuǎn)移性(包括伴有腦轉(zhuǎn)移)HER2陽性乳腺癌患者。
以往的研究證實(shí)��,Tucatinib不論是作為單一療法還是與化療或其他HER2靶向藥物聯(lián)用�,均具有較為優(yōu)異的抗癌活性����。除了獲得突破性療法資格���,該藥物還曾獲得快速通道資格、孤兒藥資格����,進(jìn)展一致被業(yè)界看好��。
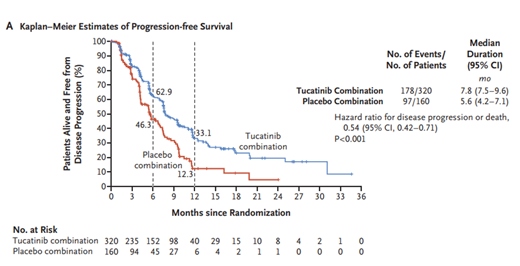
圖二 無進(jìn)展生存期(PFS)數(shù)據(jù)
此次FDA對Tucatinib的上市批準(zhǔn)��,主要是基于Seattle Genetics公司開展的一項(xiàng)涉及612例HER2陽性晚期不可切除或轉(zhuǎn)移性乳腺癌患者的臨床試驗(yàn)優(yōu)異結(jié)果����,這些患者入組前腦轉(zhuǎn)移率達(dá)48%���。試驗(yàn)結(jié)果顯示,Tucatinib-曲妥珠單抗-卡培他濱聯(lián)合用藥組的PFS為7.8個(gè)月���,高于安慰劑-曲妥珠單抗-卡培他濱組(5.6個(gè)月)。對于中位總生存期(OS)���,Tucatinib組為21.9個(gè)月�,而對照組僅為17.4個(gè)月?���;谶@一優(yōu)異的數(shù)據(jù)�����,Tucatinib目前也已經(jīng)向歐洲藥品管理局(EMA)申請上市。
二.關(guān)于"Orbis計(jì)劃"
FDA指出���,此次Tukysa(tucatinib)的上市批準(zhǔn)�����,是"Orbis計(jì)劃"框架下首次批準(zhǔn)新分子實(shí)體(NME)。"Orbis計(jì)劃"是2019年9月由FDA腫瘤優(yōu)異中心領(lǐng)銜發(fā)起的針對腫瘤產(chǎn)品的國際共同提交和審批協(xié)作框架��。Orbis在拉丁文中含有"地球�、眼睛"的意思,首次加入的機(jī)構(gòu)包括美國FDA�、澳大利亞TGA、加拿大衛(wèi)生部���。此次批準(zhǔn)Tukysa(tucatinib)���,也是FDA首次與新加坡和瑞士的監(jiān)管機(jī)構(gòu)合作。
創(chuàng)新腫瘤藥品通常會在美國優(yōu)先上市��,在其他國家上市則一般會在幾年之后��?��?紤]到全球多中心臨床試驗(yàn)是目前臨床試驗(yàn)開展的大趨勢��,未來的新藥研發(fā)可能會受益于一個(gè)全球通用的治療新標(biāo)準(zhǔn)的建立����。同時(shí)����,收集全球臨床數(shù)據(jù)也有利于新藥開發(fā)的可靠性和縮短藥物開發(fā)的時(shí)間。此次Tucatinib的新藥申請從獲得優(yōu)先審評資格到獲得批準(zhǔn)只花了2個(gè)月��,比預(yù)定時(shí)間提前了4個(gè)月��,顯示了"Orbis計(jì)劃"的優(yōu)越性���。
三.關(guān)于HER2陽性乳腺癌靶向藥
乳腺癌藥物一般可以分為:HER2陽性藥物�、HER2陰性藥物(例如帕博西尼�����、拉帕替尼���、依維莫司���、阿貝西尼等)�����、三陰性乳腺癌藥物(如Tencentriq)���。其中HER2陽性乳腺癌靶向藥是重要的一類乳腺癌藥物,目前上市的包括:曲妥珠單抗�、帕妥珠單抗、T-DM1�����、拉帕替尼��、來那替尼和吡咯替尼����。
在這些上市的HER2陽性乳腺癌靶向藥中,曲妥珠單抗�����、拉帕替尼����、帕妥珠單抗、吡咯替尼進(jìn)入了我國2020年新醫(yī)保目錄����,吡咯替尼也被稱作口服赫賽汀,在2018年上市�,為我國自主研發(fā)的創(chuàng)新藥。
全球乳腺癌發(fā)病率近年來一直呈上升趨勢���。我國雖然不是乳腺癌的高發(fā)國家�,但我國近年來乳腺癌發(fā)病率的增長速度高出高發(fā)國家1-2個(gè)百分點(diǎn)�,情況也不容樂觀。HER2陽性乳腺癌做為乳腺癌較大的一類�����,其靶向藥物研發(fā)的重要性可見一斑���。Tucatinib的獲批給HER2陽性乳腺癌帶來了新的希望��,同時(shí)����,該藥物做為"Orbis計(jì)劃"框架下批準(zhǔn)的一個(gè)新分子實(shí)體,對全球藥物審批來說也具有重要意義�����。
參考文獻(xiàn):
1. EMA Validates Seattle Genetics' Marketing Authorization Application for Tucatinib for Patients with Locally Advanced or Metastatic HER2-Positive Breast Cancer����;
2. https://www.fda.gov/news-events/press-announcements/fda-approves-first-new-drug-under-international-collaboration-treatment-option-patients-her2;
3. Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. The New England Journal of Medicine���。
聲明:本文版權(quán)歸原作者所有��,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán)��,請聯(lián)系我們��,我們將在及時(shí)修改或刪除內(nèi)容��,聯(lián)系郵箱:marketing@360worldcare.com

